
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
查看答案和解析>>
科目: 来源: 题型:阅读理解
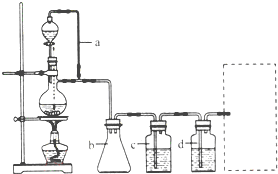 (2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
(2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| ||
| Ni,△ |
| ||
| △ |
| 催化剂 |
| 催化剂 |


查看答案和解析>>
科目: 来源: 题型:
| ||
| 红磷(少量) |

 +RCl→
+RCl→ +NaCl
+NaCl








| ||
| △ |
| 一定条件 |


查看答案和解析>>
科目: 来源: 题型:
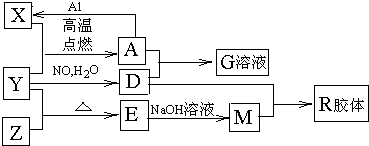


 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O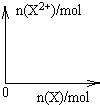
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com