
科目: 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
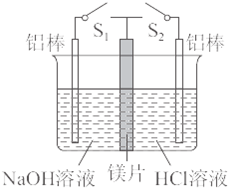 在一电解槽的中间加一镁片将其分成隔开的两部分,左侧加适量的NaOH溶液,并插入一根铝棒,右侧加适量的浓盐酸,并插入一根铝棒.如所示,下列有关说法中不正确的是( )
在一电解槽的中间加一镁片将其分成隔开的两部分,左侧加适量的NaOH溶液,并插入一根铝棒,右侧加适量的浓盐酸,并插入一根铝棒.如所示,下列有关说法中不正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com