
科目: 来源: 题型:阅读理解
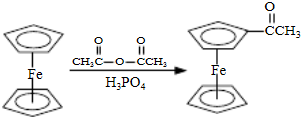
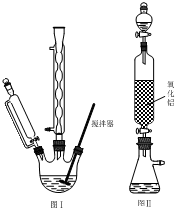 步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.
步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.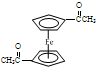 ),可以使用的仪器分析方法是
),可以使用的仪器分析方法是查看答案和解析>>
科目: 来源: 题型:
 (2013?江苏三模)在5-氨基四唑(
(2013?江苏三模)在5-氨基四唑(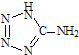 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2013?江苏三模)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(2013?江苏三模)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 15cV×10-3 | a |
查看答案和解析>>
科目: 来源: 题型:
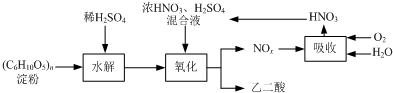
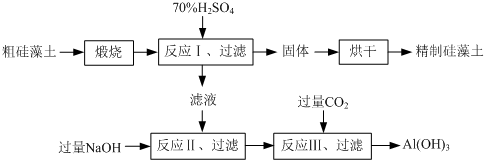
查看答案和解析>>
科目: 来源: 题型:

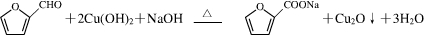
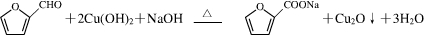


 .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以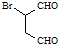 和
和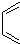 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
查看答案和解析>>
科目: 来源: 题型:阅读理解
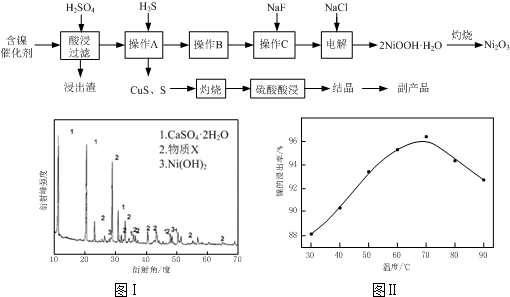
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com