
科目: 来源: 题型:
【题目】在通风橱中进行的关于铁的性质的下列实验:
步骤 

现象依次为ⅠFe表面产生大量无色气泡,液面上方变为红棕色
ⅡFe表面产生少量红棕色气泡后,迅速停止
ⅢFe、Cu接触后,其表面均产生红棕色气泡
下列说法中不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
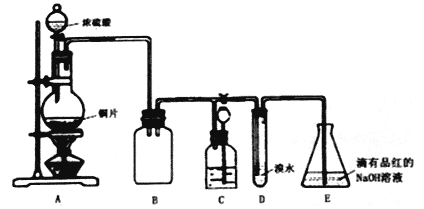
(1)装置A中发生反应的化学方程式是____________,装置B的作用是____________。
(2)设计装置D的目的是验证SO2的_____________性,E中NaOH全部转化为NaHSO3的标志是____________。
(3)装置C的作用是贮存多余的气体,C中应放置的液体是________。
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到目的是________(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液pH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
② | 滴加少量棕红色的KI3溶液,振荡 | II | |
③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl、S 2-
B.酸性溶液中可能大量存在Na+、ClO、SO42-、I
C.弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3
D.中性溶液中可能大量存在Fe3+、K+、Cl、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物的用途叙述正确的是
A. 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要娃SiO2
B. 水玻璃可用作防火剂或防腐剂
C. 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D. SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验的反应原理用方程式或电极反应式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+
B.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
C.用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
D.铅酸蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-= PbO2+4H++SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
(2)向池塘水中加入一定里的CaO2·8H2O后,池塘水中浓度增加的离子有___________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
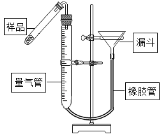
(3)CaO2在受热时能分解成CaO和O2。如图是测定样品中CaO2含量的装置。
①检查装置气密性的方法是:________________。
②加热小试管中的样品时,随着过氧化钙分解,量气瓶内的液面逐渐下降,为防止试管和量气瓶内气体压强过大,可将漏斗_______________(填“上提”或“下移”) 。
(4)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
写出O2将Mn2+氧化成MnO(O H)2的离了方程式:______________。
②取加过一定量CaO2·8H2O的池塘水样l00.00ml,按上述方注测定水中溶解氧量,消耗0.01000mol/L Na2S2O3标准溶液13.50 ml.计算该水样中的溶解氧(用mg·L-1表示), 写出计算过程。
查看答案和解析>>
科目: 来源: 题型:
【题目】从海水中提取溴的工业流程如图:
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是 。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数及相应物质:
口Br2 + 口CO32-![]() 口BrO3-+ 口Br-+ 口
口BrO3-+ 口Br-+ 口
(4)上述流程中吹出的溴蒸气, 也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏,写出溴与二氧化硫水溶液反应的化学方程式: 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.乙酸的分子式为CH3COOH,属于弱电解质
B.苯分子中没有碳碳双键,因此苯不能发生加成反应
C.交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应
D.乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在“绿色化学工艺”中,理想状态是原子利用率为100%。在用CH3C≡CH合成CH2===C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.H2和CO2 B.H2O和CO2 C.H2和CH3OH D.CO和CH3OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com