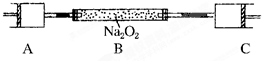
80℃,101kPa下,用如图装置进行如下实验?A?C两筒内分别装有无色气体,它们可能是NH
3?O
2?N
2?H
2S?NO?CO
2等气体,B筒内装有Na
2O
2固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化?(不考虑2NO
2═N
2O
4)
(1)C中发生反应的化学方程式是
2NO+O2=2NO2
2NO+O2=2NO2
.已知原C中的气体是单一气体,它是
NO
NO
,理由是
NO与B管进来的O2反应生成NO2的体积与原NO体积相同,只发生了颜色变化
NO与B管进来的O2反应生成NO2的体积与原NO体积相同,只发生了颜色变化
.
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前C中的气体是
NO2和NO
NO2和NO
,理由是
若C管中只有NO2,则剩余气体的体积为原来的1/3,若只有NO,则剩余气体的体积与原来相等,因而只能是NO2与NO的混合气体(3:1)
若C管中只有NO2,则剩余气体的体积为原来的1/3,若只有NO,则剩余气体的体积与原来相等,因而只能是NO2与NO的混合气体(3:1)
.
(3)若实验开始前A?C中气体体积(换算成标况)分别为1.40L和2.24L,且A中的气体经过B管后,B管增重了1.40g?经计算和推理可判定A中的气体是
CO2和O2
CO2和O2
,其质量为
2.6
2.6
g.(不必写出计算和推理过程)

 80℃,101kPa下,用如图装置进行如下实验?A?C两筒内分别装有无色气体,它们可能是NH3?O2?N2?H2S?NO?CO2等气体,B筒内装有Na2O2固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化?(不考虑2NO2═N2O4)
80℃,101kPa下,用如图装置进行如下实验?A?C两筒内分别装有无色气体,它们可能是NH3?O2?N2?H2S?NO?CO2等气体,B筒内装有Na2O2固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化?(不考虑2NO2═N2O4) 如图所示的实验装置可用来测定含两种元素的某种气体x的分子式.在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题:
如图所示的实验装置可用来测定含两种元素的某种气体x的分子式.在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题: