
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
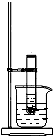 如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:
如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:
 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 CO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:查看答案和解析>>
科目: 来源: 题型:
| 3 | 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com