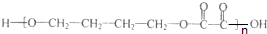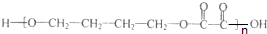某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO
4?5H
2O.
Ⅰ.取工业硫酸铜固体,用稀硫酸溶解,过滤.
Ⅱ.向滤液中滴加H
2O
2溶液,稍加热.
Ⅲ.向II的溶液中加入Cu
2(OH)
2CO
3粉末至pH为3.9~4.1.
Ⅳ.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1.
Ⅴ.加热浓缩、冷却结晶、过滤,得晶体.
已知部分阳离子生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
4.7 |
| 完全沉淀pH |
3.7 |
9.6 |
6.7 |
(1)Ⅱ中发生反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.
(2)Ⅱ中将Fe
2+氧化为Fe
3+的目的是
将Fe2+氧化为Fe3+,才能调节在pH为3.9~4.1时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀
将Fe2+氧化为Fe3+,才能调节在pH为3.9~4.1时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀
.
(3)用K
3[Fe(CN)
6](铁氰化钾)验证Ⅱ中Fe
2+是否转化完全的现象是
若有蓝色沉淀生说,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化
若有蓝色沉淀生说,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化
.
(4)Ⅲ中发生反应的离子方程式是
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,3Cu2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3+3CO2↑+6Cu2+
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,3Cu2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3+3CO2↑+6Cu2+
.
(5)应用化学平衡移动原理解释Ⅳ中“滤液用稀硫酸酸化”的原因
用稀硫酸酸化至PH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体
用稀硫酸酸化至PH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体
.