
科目: 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图12,则总反应的△H 0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。

②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高aHCl的有 。
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7] | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
A.c(SO3)=0.4mol/L
B.c(SO2)=c(SO3)=0.15mol/L
C.c(O2)=0.35mol/L
D.c(SO2)+c(SO3)=0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在Al2(SO4)3 和MgSO4 的混合溶液中,滴加NaOH 溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中 Al2(SO4)3 与MgSO4 的物质的量浓度之比为( )
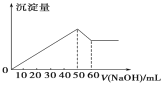
A. 1∶2 B. 2∶1 C. 6∶1 D. 3∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】有①、②、③三瓶体积相等,浓度都是1mol·L-1的盐酸溶液,将①加热蒸发至体积一半;向②中加入少量的CH3COONa固体(加入后仍显酸性);③不作任何改变。若以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所耗NaOH溶液的体积为
A. ①=②>③ B. ③>②>① C. ③=②>① D. ①=②=③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al.
A.③④
B.②③④
C.①③④
D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ 能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6 kJ·mol—1
②H2O(l) H2O(g) △H=+44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为 。
Ⅱ 甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=―890.3kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH2=―566.0kJ/mol
(3)则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
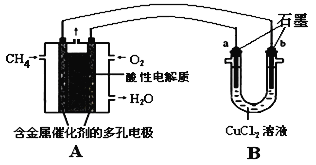
请回答:当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.相同条件下,溶液中Fe3+、Zn2+ 、Cu2+的氧化性依次减弱
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.根据反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
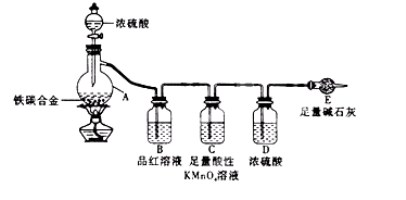
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是: _。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_______________________(任写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是______________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
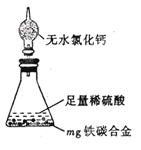
A. 用排水法测定H2的体积
B. 反应结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com