
科目: 来源: 题型:阅读理解
 二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:
二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:查看答案和解析>>
科目: 来源: 题型:
18 8 |
18 8 |
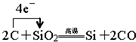

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
(2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
| ||
| ||
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | |
| N2 | 8.00 | 7.40 | 7.00 | 6.72 | 6.52 | 6.36 | 6.20 | 6.00 | 6.00 | 6.00 |
| CO | 0.00 | 1.80 | 3.00 | 3.84 | 4.22 | 4.92 | 5.40 |
查看答案和解析>>
科目: 来源: 题型:

| 700(W2-W1) |
| a |
| 700(W2-W1) |
| a |

| 280cd |
| b |
| 280cd |
| b |
查看答案和解析>>
科目: 来源: 题型:
已知298K时,2SO2(g)+O2(g)![]() 2SO3(g);△H = ?-197kJ·mol-1。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2 、0.5molO2 和1molSO3 ,达到平衡时放出热量为Q2。则下列关系正确的是
2SO3(g);△H = ?-197kJ·mol-1。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2 、0.5molO2 和1molSO3 ,达到平衡时放出热量为Q2。则下列关系正确的是
A.Q2<Q1< 197kJ B.Q2=Q1=197kJ C.Q1<Q2<197kJ D.Q1=Q2<197kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com