
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
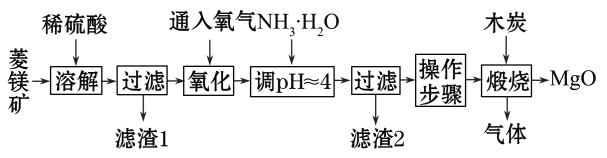
(1)通入O2氧化时,发生反应的离子方程式为________________________。
(2)滤渣2的成分是________(填化学式)。
(3)流程图中“操作步骤”为______________________、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热________(填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为__________________________。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.9~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为__________[25 ℃时,Ksp[Mg(OH)2]=5.6×10-12]。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是____________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是____________(填元素符号)。
(2)冶炼铜的主要流程如下:

气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液
用稀HNO3浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为+3的结论。请指出该结论是否合理并说明理由________。
(3)冶炼出的铜可以发生下列反应
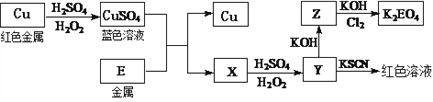
写出Cu溶于稀H2SO4和H2O2混合液的离子方程式:___________________。
写出Cl2将Z氧化为K2EO4的化学方程式:_____________________。
对于0.1molL-1 CuSO4溶液,正确的是_______
A、常温下,pH>7
B、 c(Cu2+)>c(SO42―)>c(H+)>c(OH―)
C、c(H+)+2 c(Cu2+)= 2c(SO42―)+c(OH―)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液退色;②比例模型为 |
B | ①由C和H两种元素组成;②比例模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
①A与Br2的CCl4溶液反应的生成物的名称是________________。
②B不能使溴水因发生化学反应而褪色,B与一定比例浓硫酸和浓硝酸的混合溶液发生反应,为了使反应在50~60 ℃下进行,常用的方法是_____________;反应方程式为: ________________________________,反应类型为:________反应。
③C和D反应生成相对分子质量为100的酯,生成的酯的结构简式:______。
(2)已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G, 以A为原料的合成路线如下图所示。

回答下列问题:
①D、G分子中的官能团名称分别__________、___________。
②在反应①~⑥中,属于加成反应的是________,属于取代反应的是________。(填序号)
③写出与G分子式相同的所有羧酸类的同分异构体:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列装置或操作能达到实验目的的是________(填字母序号,下同)。

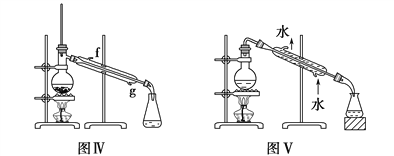
a.除去乙醇中的乙酸用图Ⅰ装置 b.形成原电池用图Ⅱ装置
c.制取乙酸乙酯用图Ⅲ装置 d.石油的蒸馏用图Ⅳ装置
e.分离Na2CO3溶液和CH3COOC2H5用图Ⅴ装置
(2)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
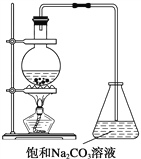
(1)写出制取乙酸乙酯的化学反应方程式____________。
(2)浓硫酸的作用是:
①_____________; ②_____________。
(3)做此实验时,还需向盛乙酸和乙醇的装置里加入几块碎瓷片,其目的是:____________________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是: __________________________________。
(5)用方程式表示为什么不能用NaOH溶液代替饱和Na2CO3溶液的原因:______。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_____________________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下面列出了几组物质,请将正确的序号填写在空格上。
①金刚石与“足球烯”C60; ②HCHO和CH3CHO; ③CH3CH2OH和CH3OCH3;④CH4和CH3CH2CH3;⑤D与T ; ⑥CH2=CH—CH2—CH3和CH3—CH=CH—CH3;⑦氧气(O2)与臭氧(O3)
同位素_________________;同系物_____________ ;
同素异形体_____________;同分异构体______________。
(2)现有下列六种有机物a.乙烷 b.乙烯 c.苯 d.乙醇 e.乙酸 f.CH2===CH—COOH g.CH2OH(CHOH)4CHO h.乙酸乙酯
①能与Na和NaOH溶液都反应的是_____________。
②分子内所有原子一定在同一平面上的有___________。
③常温下可能与溴水发生加成反应的有_____________。
④在一定条件下能发生酯化反应的有_______________。
⑤能与新制Cu(OH)2悬浊液反应的有________________。
⑥能发生水解反应的有______________。
(3)现有 A:CH3CH2OH; B:CH2OH—CH2OH;
C:CH2OH—CH(OH)—CH2OH三种有机物:
①等物质的量的这三种有机物完全燃烧耗氧量之比为______________;
②写出A与金属钠反应的化学方程式:_____________________________。
③等物质的量的这三种有机物与足量金属钠反应,同温同压下产生氢气的体积比为:__________________________。
④写出B在铜作催化剂的条件下与氧气反应的方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________,由水电离出的c(OH-)=________ mol·L-1。
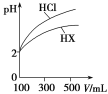
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是______________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为________(填化学式)。
②25 ℃时,在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com