①②③④⑤五种元素,在元素周期表中的位置如图所示.回答下列问题
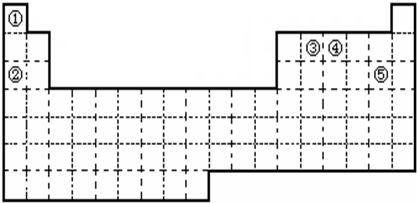
(1)①②③④⑤五种元素中,金属性最强的元素是
钠
钠
(写元素名称),该元素的单质在空气中燃烧的化学方程式为
.
(2)元素②的最高价氧化物对应的水化物的电子式为
,试比较②和③原子半径的大小②
>
>
③(填“>”或“<”)
(3)画出元素④的原子结构示意图
,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)
HNO3
HNO3
.
(4)写出元素⑤在周期表中的位置
第三周期ⅦA 族
第三周期ⅦA 族
,以海水中含量最大的物质为原料可以生产⑤的单质,同时还可以得到另外两种重的工业原料,该反应的化学方程式为
.
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍.
①甲、乙元素分别为
铝
铝
、
镁
镁
写元素名称)
②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
2NaOH+Al2O3=2NaAlO2+H2O
2NaOH+Al2O3=2NaAlO2+H2O
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN
2完全反应转化为NH
3共
放出
放出
(填“吸收”或“放出”)能量
92
92
kJ.







