
科目: 来源: 题型:
【题目】回答下列问题:
①工业上制造光导纤维的基本原料是 (填化学式)。
②下列物质中,不能用来制造耐火材料的是 。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
③在生铁和钢这2种金属材料中,含碳量较高的是 。
④铁红的主要成分的化学式是___________。
⑤明矾在生活中可用作____________剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1 ;Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
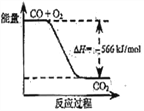
A. CO的燃烧热为283 kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或方法中,正确的是( )
A. 海水淡化 ------蒸馏 B. 将碘单质从沙子提取出来--------过滤
C. 盐水中获得食盐--------萃取分液 D. 稀释浓硫酸时将水慢慢加入浓硫酸中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述的方法不正确的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀
D.用牺牲锌块的方法来保护船身
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品。探究亚硝酸钠与硫酸的反应及生成气体产物的成分。巳知气体液化的温度:NO2:21℃;NO:-152 ℃

回答下列问题:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接): A→C→___→____→______。
(2)组装好仪器后,接下来进行的操作是____;实验开始时通入N2的作用是______.
(3)关闭弹赞夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体中含有NO,依据的现象是__________;装置E的作用是__________。
(4)根据上述实验,写出该反应的化学方程式:__________。
如果没有装置C,对验证结论造成的影响是__________。
(5)实验结束后还需通入N2的作用是_______;如果向D中通入过量O2,则装置B中发生反应的离子方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A.酸性:HClO4>H2SO4
B.Na、Mg与水反应,Na更剧烈
C.气态氢化物的稳定性:HF>HCl
D.向Na2SO3溶液中加盐酸,有气泡产生
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
(1)操作A、B的名称分别是______、_____;加入稍过量的NH4HCO3溶液的作用是_______。
(2)写出在空气中充分加热煅烧FeCO3的化学方程式:__________。
II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
(3)写出滴定过程中发生反应的离子方程式:_________。
(4)确定滴定达到终点的操作及现象为_________。
(5)上述样品的质量分数为_________。
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有______。
a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)已知反应I: 2SO2(g)+O2(g)![]() 2SO3(g),△H=-196.6kJ·mol-1
2SO3(g),△H=-196.6kJ·mol-1
反应II: 2NO(g)+O2(g)![]() 2NO2(g),△H=-113.0kJ·mol-1
2NO2(g),△H=-113.0kJ·mol-1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为________。
(2)①若在绝热恒容密闭容器中通入一定量的SO2和O2,一定条件下发生反应I,一段时间内,正反应速率随时间变化曲线如右图所示,则在a点时,反应______(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是___________。

②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:A _____B(填“>”、“=”、“< ” )。
(3)已知常温下,H2S的电离常数:K1=1.3×10-7, K2=7.1×10-15,则0.lmol/LH2S溶液的pH约为_______(取近似整数值);向浓度均为0.001mol·l-1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2-)为_______。(已知:Ksp(Ag2S)=6.3×10-50,Ksp(HgS)=1.6×10-52)
(4)NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术。现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com