
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
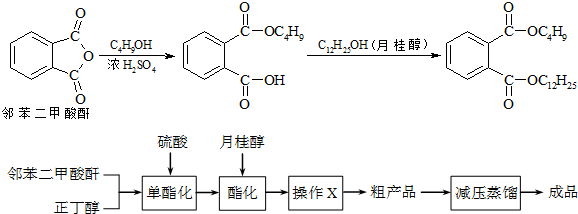
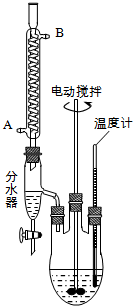
查看答案和解析>>
科目: 来源: 题型:
 (2011?泰州二模)能源、材料和信息是现代社会的三大“支柱”.
(2011?泰州二模)能源、材料和信息是现代社会的三大“支柱”.

查看答案和解析>>
科目: 来源: 题型:
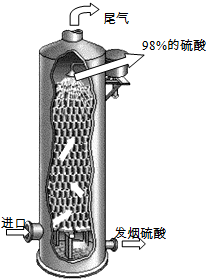 (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84.8% |
| SO3 | -- | 6.9% |
| 800Q |
| a |
| 800Q |
| a |
查看答案和解析>>
科目: 来源: 题型:








 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com