
科目: 来源: 题型:
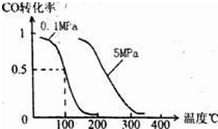 (1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0| v2 |
| a2 |
| v2 |
| a2 |
查看答案和解析>>
科目: 来源: 题型:

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中,加入 硝酸酸化的硝酸银溶液 硝酸酸化的硝酸银溶液 硝酸酸化的硝酸银溶液 硝酸酸化的硝酸银溶液 |
产生白色沉淀 | 含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中,加入 浓氢氧化钠溶液并加热, 浓氢氧化钠溶液并加热, 将润湿的红色石蕊试纸置于试管口附近 将润湿的红色石蕊试纸置于试管口附近 |
石蕊试纸变蓝色 石蕊试纸变蓝色 石蕊试纸变蓝色 石蕊试纸变蓝色 |
含有NH4+ k |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 作物 | 水稻 | 小麦 | 玉米 | 大豆 | 油菜 | 棉花 | 马铃薯 | 洋葱 | pH | 6~7 | 6.3~7.5 | 6~7 | 6~7 | 6~7 | 6~8 | 4.8~5.5 | 6~7 |
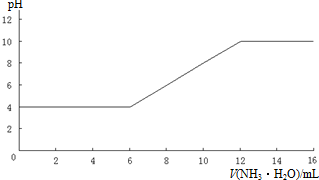
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com