
科目: 来源: 题型:
【题目】酸牛奶中含有乳酸,乳酸具有帮助消化、增进食欲的功能,其结构简式为: 。下列关于乳酸的说法错误的是
。下列关于乳酸的说法错误的是
A. 1mol乳酸与足量金属钠反应生成lmolH2
B. 既是乙醇的同系物,又是乙酸的同系物
C. 可与乙醇、乙酸反应,且反应类型相同
D. 与有机物HOCH2CH2COOH互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素x、y、z、m、n在元素周期表中的位置如图所示,则下列说法中错误的是
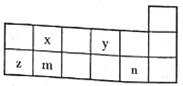
A. 最高价氧化物的水化物的酸性由弱到强的顺序是m、x、n
B. y、n分别与金属钠形成的化合物中均只含有离子键
C. y、z、n分别形成的简单离子半径的大小为n>y>z
D. x、z、m、n的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目: 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
则CO还原H2O(g)的热化学方程式为__________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:______________________________________________________________。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:___________。

(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的_______(填“正”或“负”)极,B极区电解液为_______(填化学式)溶液,该离子交换膜是_______(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因_________________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】若m g密度为ρ g·cm-3的Al2(SO4)3溶液中含SO42— n g,则该Al2(SO4)3溶液的物质的量浓度是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子中σ键重叠方式的分析不正确的是
A | B | C | D |
H2 | HCl | Cl2 | ClF |
两个氢原子的s轨道重叠 | 氢原子的s轨道和氯原子的p轨道重叠 | 一个氯原子的s轨道和另一个氯原子的p轨道重叠 | 氯原子的p轨道和氟原子的p轨道重叠 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A. 盐酸中逐滴加入氢氧化钠溶液
B. 硫酸铜溶液中逐滴加入氢氧化钡溶液
C. 硫酸中逐滴加入氯化钡溶液
D. 盐酸中逐滴加入硝酸银溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】对于玻璃器皿上黏有的一些水洗不掉的残留物,下列洗涤方法正确的是
①残留在试管内壁上的碘,用酒精洗涤
②试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤
A. ①③④ B. ②③④ C. ①②④ D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将224LHCl气体溶于635mL水(ρ=1.00 g/mL)中,所得盐酸溶液密度为1.18 g/mL。
(1)则此溶液物质的量浓度应为___________;
(2)若取出这种盐酸溶液10.0mL,向其中加水配制成1L溶液,则所得稀盐酸的物质的量浓度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com