
科目: 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为________ L。
(3)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________________,其物质的量之比为________。
(4)曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________________,其物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污B. 加热稀醋酸溶液其pH稍有减小
C. 浓的硫化钠溶液有臭味D. 小苏打溶液与AlCl3溶液混合产生气体和沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+、和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是_______和____________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当 C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为__________(填序号)。
a.Br- b. SO42- c.CH3COO- d. HCO3-
(3)将19.2gCu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式_____________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是___________________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表代表周期表中的几种短周期元素,下列说法中错误的是( )

A. ED4分子中各原子均达8电子结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. A、B、C第一电离能的大小顺序为C>B>A
D. C、D气态氢化物稳定性强弱和沸点高低均为C>D
查看答案和解析>>
科目: 来源: 题型:
【题目】分别取V L含有Na2SO4和Al2(SO4)3的混合溶液两等份,一份加入含a mol NaOH的溶液,恰好使Al3+完全转化为AlO2-;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4。则原混合溶液中Na+的浓度为 ( )
A. 8b-3a/2V molL-1 B. 8b-3a/4V molL-1
C. a-2b/V molL-1 D. a-2b/2V molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为 (填“吸热”或“放热”)反应,其中ΔH=
(用含有a、b的关系式表示)。
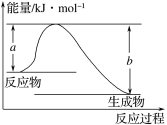
(2)若图示中表示反应H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b= kJ·mol-1,x= 。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b= kJ·mol-1,x= 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为 。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的热量变化为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是

A. 若a为单烯烃,则d与f的最简式一定相同
B. 若d的相对分子质量是44,则a是乙炔
C. 若a为苯乙烯(![]() ),则f的分子式是C16H32O2
),则f的分子式是C16H32O2
D. 若a的相对分子质量是42,则d是乙醛
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO![]() ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO![]() 的离子方程式为____________________。
的离子方程式为____________________。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)H2O2的作用是______________。
(3)调pH=8是为了除去__________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
![]() Na2Cr2O7+
Na2Cr2O7+![]() SO2+
SO2+![]() H2O===
H2O===![]() Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+![]() Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________;
②________________________________________________________________________;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国石油天然气集团在四川发现了中国最大的天然气田,预计储量达7000亿立方米。天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关的说法不正确的是( )
A.甲烷与丙烷互为同系物
B.甲烷不能使高锰酸钾酸性溶液褪色
C.乙烷和氯气在光照的条件下可以发生取代反应
D.甲烷、乙烷、丙烷中的化学键都是极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】某样品中含有碳酸钠及少量的硫酸钠和氯化钠,某学生为检验其中的阴离子,按照下图程序进行实验,所加试剂均过量。(可供选择的试剂有:稀硫酸、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液)

回答下列问题:
(1)①试剂1是________结论1是________;
②试剂2是________结论2是________;
③试剂3是________结论3是________ 。
(2)写出有关反应的离子方程式
①__________________;
②__________________;
③__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com