
科目: 来源: 题型:
【题目】下列现象中,不是因为发生化学反应而产生褪色现象的是( )
A. 将苯滴入溴水中,振荡后水层接近无色 B. 乙烯使KMnO4酸性溶液褪色
C. 乙烯使溴的四氯化碳溶液褪色 D. 甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目: 来源: 题型:
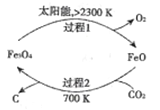
【题目】二氧化碳的回收利用是环保领域研究热点。
(l)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示,总反应的化学方程式为_________。
(2)工业上可用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和液态水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为___________。
(3)如利用CO2和CH4重整可制合成气(主要成分为CO、H2), 其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量均为1mol的CH4和CO2,在一定条件下发生反应。CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:
2CO(g)+2H2(g)。在密闭容器中通入物质的量均为1mol的CH4和CO2,在一定条件下发生反应。CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:
①压强:P1_____P2(填“>”、“=”或“<”,下同) , y点:V正_______V逆。
②已知气体分压(P分)=气体总压(P总)×气体的体积分数。用气体分压代替平衡浓度可以得到平衡常数KP,求X点对应温度下反应的平衡常数KP=________。

(4)Na2CO3溶液也通常用来捕获CO2,发生如下反应:CO32-+CO2+H2O![]() 2HCO3-,用0.12mol/LNa2CO3溶液若吸收CO2一段时间后,溶液的pH=7,溶液中c(HCO3-)/c(CO32-)=10,则溶液中的c(CO32-) =__________。
2HCO3-,用0.12mol/LNa2CO3溶液若吸收CO2一段时间后,溶液的pH=7,溶液中c(HCO3-)/c(CO32-)=10,则溶液中的c(CO32-) =__________。
(5)甲醇燃料电池(简称DMFC)可作为常规能源的替代品而备受关注。DMFC的工作原理如图所示:
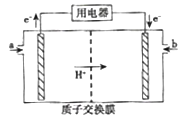
①加入a物质的电极是电池的______(填“正”或“负”)极,其电极反应式为_______。
②常温下以该装置作电源,用情性电极电解NaCl和CuSO4的混合溶液,当电路中通过0.4 mol 电子的电量时,两电极均得到0.14mol的气体。若电解后溶液体积为40L,则电解后溶液的pH=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O下列有关说法中不正确的是( )
A.HNO3在反应中既表现氧化性也表现出酸性
B.每生成22.4 L NO(标准状况)有3 mol电子转移
C.HNO3作氧化剂,铜作还原剂,3 mol Cu还原8 mol的HNO3
D.HNO3作氧化剂,铜作还原剂,3 mol Cu还原2 mol的HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮及其化合物广泛存在于自然界中,回答下列问题:
(1)碳在形成化合物时,其键型以共价键为主,原因是__________。
(2)CS2分子中,共价键的类型有_______ , C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型的分子或离子_______。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是______;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(g)+ N2H4(g)=2N2(g)+4H2O(g) △H=-1038.7kJ/mol。若该反应中有4molN-H键断裂,则形成的π键有___mol。
③肼能与硫酸反应生成N2H6SO4, N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在____ (填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图29所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为______。其晶胞参数(晶胞边长)为1.4nm,晶体密度为____g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去). 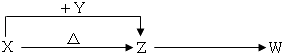
请回答:
(1)W的化学式是;
(2)X与Y在溶液中反应的离子方程式是:;
(3)X ![]() Z中反应的化学方程式是: .
Z中反应的化学方程式是: .
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钻渣[含Co(OH)2、Fe2O3、Al2O3、MnO等)可以来制取钻的氧化物和CoCl2·6H2O,工艺流程如图所示:
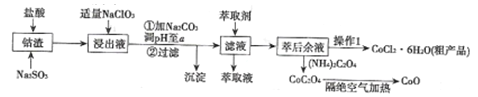
①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为________。
(2)流程中加人适量的NaClO3的作用是___________。若加入NaClO3过量,可能产生有毒气体,写出生成该有毒气体的离子方程式___________________。
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是___________。沉淀的主要成分是______。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是________;其使用的最佳pH范围是________。
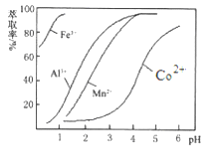
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是______、______和过滤。
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为( )
A.形成原电池时铝作负极 B.形成原电池时铜作负极
C.形成原电池时,电流由铝经导线流向铜 D.铝铆钉发生了化学腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,浓度均为1.0mol/L的HX溶液、HY溶液,分别加水稀释.稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX是强酸,溶液每稀释10倍.pH始终增大l
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a 点大于b 点
D. 消耗同浓度的NaOH溶液体积:a 点大于b 点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com