
科目: 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:NO (g) +CO(g)![]()
![]() N2(g) +CO2 (g) △H=-373.2 kJ/mol达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g) +CO2 (g) △H=-373.2 kJ/mol达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( ) 
A.Cu与稀盐酸
B.NH4HCO3与稀盐酸
C.CaCO3与稀硫酸
D.NaHCO3与NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
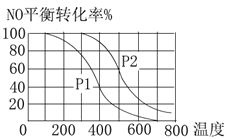
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”或“减小”)。
(2)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),已知随温度升高,此混合气体的颜色变深。
2NO2(g),已知随温度升高,此混合气体的颜色变深。
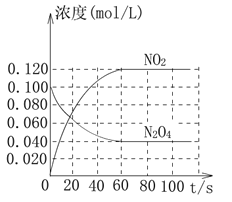
回答下列问题:
①反应的ΔH_________________________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为____________________。
②100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。列式计算温度T时反应的平衡常数K2=_________________。
③温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
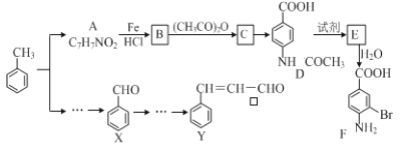
已知:①![]()
![]()
![]()
②![]()
③CH3COOH+CH3COOH→(CH3CO)2O+H2O
请回答下列问题:
(1)下列有关F的说法正确的是______________。
A.分子式是C7H7NO2Br B.F即能与HCl又能与NaOH应生成盐
C.能发生取代反应和缩聚反应 D.1 mol的 F最多可以和2 mol NaOH反应
(2)C→ D的反应类型是 _____。
(3)在合成F的过程中,B→C步骤不能省略,理由是_____________________。
(4)D→E反应所需的试剂是 ___________________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)_________________。
①苯环上只有两种不同化学环境的氢原子②分子中含有-CHO
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。___________ 注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在800 mL的大烧杯中放入碎纸屑把盛有50 mL 0.50 mol·L-1盐酸的100 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根环形玻璃搅拌棒和一支温度计,测定溶液的温度。迅速往盐酸中加入 50 mL 0.55 mol·L-1NaOH溶液,盖好盖子,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装有反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。

(1)烧杯间填满碎纸屑的作用是_____________________________________________。
(2)要重复进行三次实验的目的是___________________________________________。
(3)三次实验测得的数据中,起始时盐酸与NaOH溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为① 2.3℃,② 2.4 ℃,③2.5 ℃。则此次实验实际测得的中和热值为___________。
(4)烧杯若不盖泡沫塑料板,求得的中和热数值将__________________(填“偏大”“偏小”或“无影响”)。
(5) 实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行上述反应,与上述实验相比,所放出的热量____________________(填“相等”或“不相等”),所求中和热___________________ (填“相等”或“不相等”),理由是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.由H原子形成1 mol H—H键要吸收热量
B.所有燃烧反应都是放热反应
C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
① 2H2(g)+O2(g)===2H2O(l)ΔH=-570.0 kJ·mol-1
②H2O(g)===H2(g)+![]() O2(g)ΔH= +241.8 kJ·mol-1
O2(g)ΔH= +241.8 kJ·mol-1
③C(s)+![]() O2(g)===CO(g)ΔH=-110.5 kJ·mol-1
O2(g)===CO(g)ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是___________________。(填序号)
(2)H2的燃烧热ΔH=___________________;C的燃烧热ΔH=___________________。
(3)燃烧10 g H2生成液态水,放出的热量为___________________。
(4)如果需要释放787kJ的热量,需要完全燃烧____________________g的碳。
(5)CO的燃烧热ΔH=____,其热化学方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A. 萃取、过滤、蒸馏、蒸馏 B. 过滤、分液、蒸馏、萃取
C. 过滤、蒸馏、过滤、蒸馏 D. 过滤、分液、过滤、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com