
科目: 来源: 题型:
【题目】下列有关实验操作的叙述合理的是
A. 用pH试纸测定溶液pH时,不需要预先润湿
B. 蒸馏实验中,忘记加沸石,应立即趁热加入沸石
C. 要量取15.80mL溴水,须使用棕色的碱式滴定管
D. 用氢氧化钠溶液检验FeCl3溶液中混有的Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 物质的量就是物质的数量 B. 物质的量是国际单位制中基本物理量之一
C. 阿伏加德罗常数就是6.02×1023mol-1 D. 物质的量的单位——摩尔只适用于分子、原子、离子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子: ![]() Cl
Cl
B.氯离子(Cl﹣)的结构示意图: 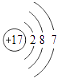
C.氯分子的电子式: ![]()
D.氯化氢的结构式:H﹣Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.O2、O3互为同位素
B.1H、2H、3H、H+、H2是氢元素形成的五种不同粒子
C.正丁烷和异丁烷互为同系物
D.乙烷、乙烯互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知丙烷的燃烧热△H=﹣2215kJmol﹣1 . 若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A.55kJ
B.220kJ
C.550kJ
D.1108kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 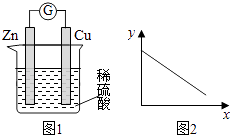
A.铜棒的质量
B.c(Zn2+)
C.c(H+)
D.c(SO42﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时才有I2析出。某课题组用0.02mol/LNaHSO3溶液和0.02mol/L KIO3溶液,以及淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:__________________________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | NaHSO3溶液(mL) | KIO3溶液(mL) | H2O(mL) | 反应温度(℃)/ | 变蓝时间(t/s) |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=_________,b=_________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。

①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率为_______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你描述低于50℃时,溶液变蓝所需时间与反应温度的关系:__________________。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组在排除浓度、温度等影响因素后,对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;I2浓度越大反应速率越快;
假设二:________________________________________________________;
假设三:________________________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案 | 预期实验现象和结论 |
第一步:在烧杯甲中将NaHSO3溶液与过量KIO3 溶液混合, 用测速仪测定起始时的反应速率V(甲) 第二步:在烧杯乙中________________________,测定其起始阶段的相同时间内的反应速率V(乙) | 若__________,则假 设一成立 |
查看答案和解析>>
科目: 来源: 题型:
【题目】aLAl2(SO4)3溶液中含有Al3+为b mol,则该溶液里SO42-的物质的量浓度为
A. 3b/2aB. 2b/3aC. 2b/aD. 3b/a
查看答案和解析>>
科目: 来源: 题型:
【题目】用所学知识填写下列空白:(填代号)
(1)下列物质:①金属铜 ②固态NaCl ③液氧 ④盐酸 ⑤碳棒 ⑥酒精 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩天然气
属于电解质的是__________;属于非电解质是__________;能导电的化合物是__________。
(2)常温下,将1mLpH=1的H2SO4的溶液加水稀释到100mL,稀释后的溶液中c(SO42-)∶c(OH-) =_______________;
(3)某温度时,测得0.01 molL-1 NaOH溶液的pH为11,则该温度下水的离子积常数Kw=______。在该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.若所得混合液为中性,且a=12,b=2,则Va:Vb=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com