
科目: 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T-细胞淋巴瘤,其合成路饯如下图所示:
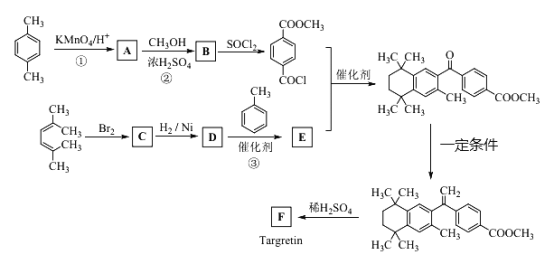
已知:①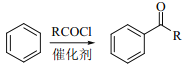
②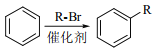
③![]() (R表示烃基或芳基)
(R表示烃基或芳基)
(1)反应①的反应类型是______________________
(2)反应②的化学方程式_________________________________________。
(3)C的结构简式是_____________________________________________。
(4)反应③的化学方程式____________________________________________。
(5)F的分子式C24H28O2,F中含有的官能团____________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构)________________________________。
结构)________________________________。
a.苯环上的一氯代物有两种 b.既发生银镜反应又能发生水解反应
(7)已知: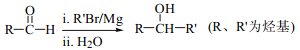 ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5H2O与硫酸反应的化学方程式___________________________。为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有___________________________(写出两条)。
(2)利用____________的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是_______________。(化学式)
(3)“净化除杂”需先加H2O2溶液,作用是__________________________。然后再调节溶液的pH约为5,目的是__________________________。
(4)“粗硼酸”中的主要杂质是_____________ (填化学式)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为____________。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
(1)实验原理。
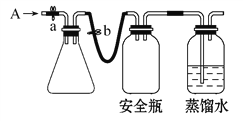
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为____________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2Na2S2O32NaI+Na2S4O6。
(2)实验步骤。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是_________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含mmol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及一定浓度的硫酸(含H2SO4nmol);
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂;
⑧用0.005 mol·L-1Na2S2O3溶液滴定至终点。滴定终点的现象是_____________。
(3)数据分析。
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将__________(填“偏大”“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)NH3、N2H4在工业生产和国防建设中都有广泛应用。
①N2H4(g)![]() N2(g)+2H2(g) △H1=akJ·mol-1
N2(g)+2H2(g) △H1=akJ·mol-1
②N2(g)+3H2(g)![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
③7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
则△H3=_________(用含a和b的代数式表示)
(2)N2中存在_________键(填“极性”或“非极性”),NH3的VSEPR模型是______________。用短线表示共价键,小黑点表示孤对电子的结构式叫路易斯结构式,NH4的路易斯结构式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( ) 
A.a点对应的溶液中:Na+、OH﹣、SO42﹣、NO3﹣
B.b点对应的溶液中:Al3+、Fe3+、NO3﹣、Cl﹣
C.c点对应的溶液中:Na+、Ca2+、NO3﹣、Cl﹣
D.d点对应的溶液中:Cl﹣、NO3﹣、Fe2+、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:①C (s)+ 1/2O2(g)=CO (g)△H1=-l26.4kJ·mol-1
②C(s)+O2(g) =CO2(g)△H2=-393.5kJ·mol-1
③S(s)+O2(g)=SO2(g)△H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
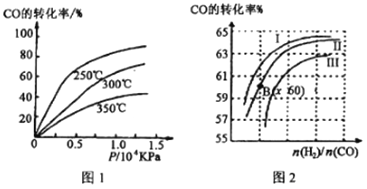
①CO转化率与温度、压强的关系如图所示,该反应△H_____________0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为_____________________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=_________________________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:
4OH--4e-=O2↑+2H2O;_________________________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_____________kg(结果保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类
A、75%的酒精溶液 B、硝酸钠
C、Fe(OH)3胶体 D、豆浆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com