
科目: 来源: 题型:
【题目】下列溶液与100 mL 0.5 mol/L NaCl溶液中所含的Cl-物质的量浓度相同的是
A. 100 mL 0.5 mol/L MgCl2溶液 B. 200 mL 0.25 mol/L AlCl3溶液
C. 50 mL 1 mol/L NaCl溶液 D. 25 mL 0.5 mol/L HCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还含有少量Fe2O3、SiO2等杂质)提取氧化铝

操作过程如下:
(1)沉淀A中主要含有 (填化学式),沉淀B中含有 (填化学式);
(2)(Ⅰ)(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(3)滤液X中,除了H+、Fe3+外,还含有大量的阳离子是 ;
(4)写出(Ⅳ)步骤中氢氧化铝加热分解的化学方程式: ;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.纯碱是焙制糕点所用的发酵粉的主要成分之一
B.硫酸可用于金属矿石的处理和金属材料的表面清洗
C.还原铁粉可用作食品袋内的抗氧化剂
D.丙三醇俗称甘油,吸湿性强,可用于护肤
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.
请回答下列问题:
(1)鉴别甲烷和乙烯的试剂是(填选项字母).
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(2)下列物质中,不能通过乙烯加成反应得到的是(填选项字母).
A.CH3CH3
B.CH3CHCl2
C.CH3CH2OH
D.CH3CH2Br
(3)已知2CH3CHO+O2 ![]() 2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下所示:
2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下所示:
乙烯 ![]() A
A ![]() B
B ![]() 乙酸,反应②的化学方程式为 .
乙酸,反应②的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)仪器a的名称____________。
(2)请写出a中发生主要反应的方程式____________。
(3)瓶b的作用有____________。请写出发生堵塞时瓶b中的现象____________。
(4)提纯d中粗产品的方法是____________。
(5)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如右图所示,图中只有Hg(OH)2为难溶物[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=lgc(Cl-)]。

(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是_______。少量Hg(NO3)2溶于0.001mol/L盐酸后得到无色透明溶液,其中汞元素的主要存在形态是_______。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是_______(用离子方程式表示),为了防止出现浑浊,可采取的措施是_______。
(3)HgCl2是一种弱电解质,结合图像写出其电离方程式为_______。
(4)当溶液PCl保持在4,pH由7改变为3时,可使Hg(OH)2转化为HgCl2,请写出对应的离子方程式_______。
(5)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水,反应的离子方程式为_______。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。己知Ksp(HgS)=1.6×10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ksp(AgC1)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是
A. 向同浓度的Na2CrO4和NaC1混合溶液中滴加AgNO3溶液,AgCl先析出
B. 向AgCl饱和溶疲中加入NaCl晶体,有AgCl析出且溶液中cCl-)=c(Ag+)
C. AgCl和Ag2CrO4共存的悬浊液中, 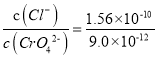
D. 向Ag2CrO4悬池液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
查看答案和解析>>
科目: 来源: 题型:
【题目】紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )
A. 10 B. 34 C. 44 D. 78
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下表数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-33 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A. 向该混合溶液中逐滴加入NaOH溶液: 最先看到红褐色沉淀
B. 该溶液中c(SO42-): [c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C. 向该溶液中加入适量氯水,并调节pH到4后过滤,可获得纯净的CuSO4溶液
D. 在:pH=5的溶液中Fe3+不能大量存在
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,密闭容器中发生反应M(g)![]() N(g),反应过程中的能量变化如图中曲线1所示。下列说法错误的是
N(g),反应过程中的能量变化如图中曲线1所示。下列说法错误的是

A. 该反应正反应活化能为(E3-E2)kJmol-1
B. 该反应的反应热为(E1-E2) kJmol-1
C. 曲线II表示其他条件不变,升高温度时的能量变化
D. 曲线III表示其他条件不变,加入催化剂时的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com