
科目: 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
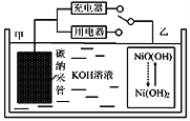
A. 放电时,乙电极反应为:Ni(OH)2+OH- e=NiO(OH)+H2O
B. 放电时,甲电极为正极,OH移向乙电极
C. 电池总反应为H2+2NiO(OH) ![]() 2Ni(OH)2
2Ni(OH)2
D. 充电时,电池的碳电极与直流电源的正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.2mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀).
A. ①和② B. ②和④ C. ③和④ D. ①
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象的描述错误的是( )
A.氢气在氯气中燃烧生成绿色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C. Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D. Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为
A. 2∶1 B. 1∶1 C. 1∶2 D. 3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积.
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
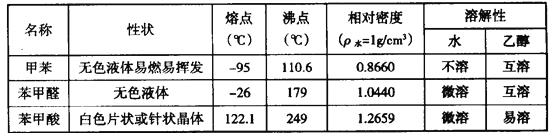
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性: 苯甲酸>醋酸
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
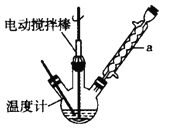
(1)装置a的名称是____ ____,主要作用是 。三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达 。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________。
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.200g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。
③下列情况会使测定结果偏低的是__________(填字母)。
a.滴定终点时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求作答:
(1)漂白粉的有效成分为(填化学式),漂白粉在空气中久置容易变质、失效,有关反应的化学方程式为、
(2)工业上制取氯气有关反应的化学方程式为
(3)铁在氯气中燃烧有关反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等。其水溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
(1)已知有关物质溶解度如图1。用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入_________(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时,_____________,抽滤得到粗产品,再用重结晶法提纯粗产品。
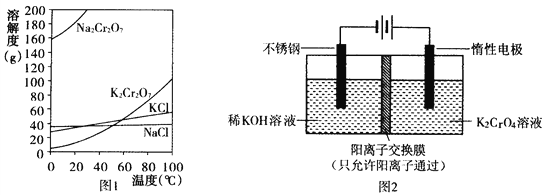
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2。
①不锈钢作________极,写出该电极的电极反应式________________________。
②分析阳极区能得到重铬酸钾溶液的原因________________________。
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为____________。
(3)铬对环境能造成污染。某酸性废水中含有![]() ,处理时可用焦亚硫酸钠(Na2S2O5)将
,处理时可用焦亚硫酸钠(Na2S2O5)将![]() 转化为毒性较低的Cr3+,再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mg·L-1则达到排放标准。
转化为毒性较低的Cr3+,再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mg·L-1则达到排放标准。
①Na2S2O5参加反应的离子方程式为____________________。
②经上述工艺处理后的废水,理论上Cr3+浓度约为__________mg·L-1。(已知室温下Ksp≈6×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com