
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为 ![]() NA
NA
B.100ml 0.1mol/LCH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01NA
C.0.1mol CH4所含质子数为NA
D.0.5mol C2H4中含有的C=C双键数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
回答下列问题:
(1)盛装浓盐酸的仪器名称为 , 进行实验时,应先点燃(选填A或C)处酒精灯.
(2)制取无水氯化铁的实验中,A中反应的离子方程式为 , 装置B中加入的试剂是 .
(3)制取的无水氯化铁中混有少量氯化亚铁,其原因是(化学方程式表示).为除去氯气中混有的少量HCl,可以在装置A、B间加入装有的洗气瓶.
(4)工业上常用石灰乳吸收制氯气的尾气制得漂白粉,漂白粉的有效成分是(填化学式).长期露置于空气中的漂白粉,加稀盐酸后产生的气体是(填数字代号).
①O2 ②Cl2 ③CO2 ④HClO.
查看答案和解析>>
科目: 来源: 题型:
【题目】关于吸热反应和放热反应,下列说法中错误的是
A. 反应物的总能量高于生成物的总能量时,发生放热反应
B. 需要加热才能进行的化学反应一定是吸热反应
C. 化学反应中的能量变化,除了热量变化外,还可以转化为光能、电能等
D. 化学反应过程中的能量变化,服从能量守恒定律
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是
A. 氢氧化钡溶液与硫酸的反应 OH+H+ = H2O
B. 澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C. 铜片插入硝酸银溶液中 Cu + Ag+ = Cu2+ + Ag
D. 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.铝的金属活泼性强,可用于制作铝金属制品
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.氢氧化铝受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于净水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质性质和用途都正确且相关的是( )
选项 | 性质 | 用途 |
A | FeCl3溶液显酸性 | 用于刻蚀电路板 |
B | SO2具有氧化性 | SO2常用于漂白秸秆、织物 |
C | HF溶液具有酸性 | HF溶液能在玻璃上刻图案 |
D | CH3CH2OH完全燃烧生成二氧化碳和水并放出大量热量 | 乙醇常作清洁能源 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】把5.1g镁铝合金的粉末放入过量的300mL 2molL﹣1盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝和镁的物质的量之比.
(2)在反应后的溶液中加入4molL﹣1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断不正确的是
A. 沉淀H为AI(OH)3、BaCO3的混合物
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C. 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+
D. 若溶液X为100mL,产生的气体A为44.8mL(标况),则X中c(Fe2+)=0.06mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+ . 为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图.请完成下列问题.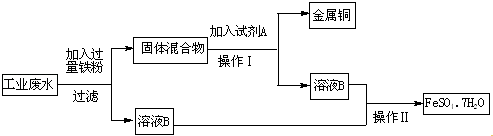
(1)检验工业废水中含有Fe3+的方法是 .
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 .
(3)操作Ⅰ为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com