
科目: 来源: 题型:
【题目】下列不能用平衡移动原理解释的事实是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 氢气、碘蒸汽、碘化氢气组成的平衡体系加压后颜色变深
C. 淡黄绿色的氯水光照后颜色变浅
D. 合成氨工业反应过程中适时分离反应产物
查看答案和解析>>
科目: 来源: 题型:
【题目】200mL 0.3molL﹣1的K2SO4溶液和100mL 0.2molL﹣1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO ![]() 的物质的量浓度为( )
的物质的量浓度为( )
A.0.3 molL﹣1
B.0.4 molL﹣1
C.0.45 molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。己知:酸性条件下,锡在水洛液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化、易水解生成碱式氯化亚锡(Sn(OH)Cl);SnCl4极易水解。请按要求回答下列相关问题:
(1)锡原子的核电荷数为50,锡的原子结构示意图为________________。
(2) SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因____________。
SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为______________。
(3)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: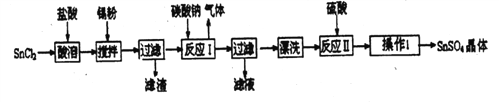
①操作Ⅰ是___________。
②加入Sn粉的作用有两个:a.调节溶液pH; b.__________.
③反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______________。
(4)锡粉可用于微电子器件生产,该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将1.2g试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2↑;②加入过量的FeCl3;③用0.1 mol/L的K2Cr2O7滴定生成的Fe2+ (己知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液32mL。则锡粉中锡的质量分数是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目: 来源: 题型:
【题目】在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10mL 0.l mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A. 中和时所需NaOH的量 B. 与Mg反应的起始速率
C. OH-的物质的量浓度 D. 溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中,有广泛应用,它的工作原理如下:Cd+2NiO(OH)+2H2O ![]() Cd(OH)2+2Ni(OH)2.下列叙述正确的是
Cd(OH)2+2Ni(OH)2.下列叙述正确的是
A. 该电池放电的时候,负极附近pH增大
B. 放电时每转移2mol电子,有2mol NiO(OH)被氧化
C. 充电时,阳极反应式是Ni(OH)2-e-+OH-=NiO(OH)+H2O
D. 充电时,Cd电极接电源正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com