
科目: 来源: 题型:
【题目】在苯的同系物中加入少量KMnO4酸性溶液,振荡后褪色,正确的解释为 ( )
A.苯的同系物分子中的碳原子数比苯分子中的碳原子数多
B.苯环受侧链影响易被氧化
C.侧链受苯环影响易被氧化
D.由于苯环和侧链的相互影响均易被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】不能用离子方程式 CO ![]() +2H+=CO2↑+H2O表示的反应是( )
+2H+=CO2↑+H2O表示的反应是( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O
B.K2CO3+2HNO3=2KNO3+CO2↑+H2O
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题: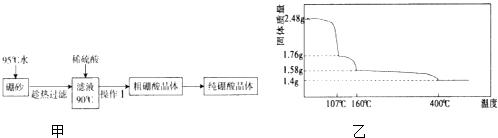
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 , 天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为 .
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O710H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
①写出硼砂溶液和稀硫酸反应的离子方程式 .
②上述流程中获得粗硼酸晶体的操作Ⅰ为、过滤,进一步将粗硼酸晶体提纯的方法是 .
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 .
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为 .
②硼酸加热到160℃得到的固体的化学式为 . (B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显﹣1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4 , 其反应方程式为NaBO2+2H2O=2O2↑+NaBH4 , 则阴极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4yFeSO4zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
①NH4+含量测定:称取9.8g硫酸亚铁铵晶体,加适量水溶解,注人如图所示的三颈瓶中,然后逐滴加人足量lO%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用lOOmL 1.0molL﹣1的盐酸标准溶液吸收.
蒸氨结束后取下接收瓶,用1.0molL﹣1NaOH标准溶液滴定剩余的HCl,到终点时消耗50mlNaOH溶液.
②Fe2+含量测定:向上述实验后的三颈瓶中加入过量的3%的双氧水,充分反应后过滤、洗涤、灼烧得到2.0g固体.
③结晶水含量测定:称取9.8g硫酸亚铁铵晶体,在质量为15g的坩埚中加热至200℃,恒温一段时间,置于空气中冷却,称量质量为22.3g;重复上述加热、冷却、称量过程,发现两次称量结果相同.回答下列问题: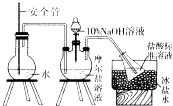
(1)装置中安全管的作用原理是 .
(2)冰盐水的作用是 .
(3)用NaOH标准溶液滴定剩余的HCl时,可使用的指示剂是 .
(4)测定Fe2+时.加人双氧水发生反应的化学方程式是 .
(5)如果在测定NH4+含量的过程中,亚铁元素部分被氧化,对Fe2+含量的测定(填“有”或“无”)影响.
(6)根据①、②的数据,该摩尔盐晶体中n(NH4+):n(Fe2+):n(SO42﹣ )= , z= .
(7)根据③的数据,发现结晶水含量测定结果偏低.从实验过程分析,可能原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个电化学过程的示意图. 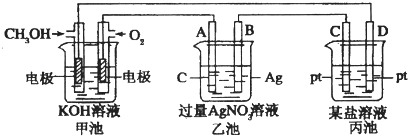
请回答下列问题:
(1)图中甲池是(填“原电池”“电解池”或“电镀池”).
(2)A(石墨)电极的名称是(填“正极”“负极”“阴极”或“阳极”).
(3)写出通入CH3OH的电极的电极反应式
(4)乙池中反应的化学方程式为当乙池中B(Ag)极质量增加5.4g,甲池中理论上消耗O2的体积为L(标准状况),此时丙池中某电极析出1.6g某金属,则丙池中的某盐溶液可能是 A.MgSO4B.CuSO4 C.NaCl D.AgNO3 .
查看答案和解析>>
科目: 来源: 题型:
【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
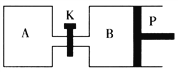
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍具有优良的物理和化学特性,是高技术产业的重要原料. 羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)Ni(CO)4(g)
①当温度升高时, ![]() 减小,则△H0(填“>”或“<”).
减小,则△H0(填“>”或“<”).
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是(填代号)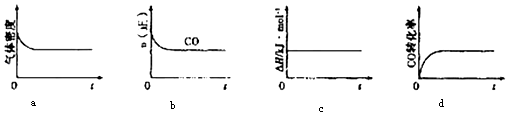
在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数(填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0﹣3s内的平均反应速率v(CO)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com