
科目: 来源: 题型:
【题目】甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)CO2(g)+3H2(g)△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 .
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) . ①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答: 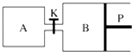
①反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为;A、B两容器中H2O(g)的体积百分含量的大小关系为:BA(填“>”“<”或“=”).
②若打开K,一段时间后重新达到平衡,容器B的体积为L(连通管中气体体积忽略不计,且不考虑温度的影响).
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,﹣2 | ﹣1 | ﹣2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)C元素在元素周期表中的位置 . B形成的简单离子的结构示意图 .
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是(填化学式).
(3)用电子式表示A、D形成化合物的过程: .
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为 .
(5)GE2的电子式为 , F与G形成的最简单的化合物的结构式为 .
(6)E的氢化物比C的氢化物的熔沸点高的原因是 .
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) .
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl﹣、SO42﹣、HCO3﹣、Na+、K+、Mg2+ , 所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g.关于原溶液组成的结论,不正确的是( )
A.一定存在SO42﹣、HCO3﹣、Mg2+ , 至少存在Na+、K+中的一种
B.为了确定是否存在Cl﹣ , 可向溶液中加入硝酸酸化的硝酸银溶液
C.c(HCO3﹣)=0.05mol/L
D.4.88g沉淀中含有3种成分
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2NO2(g)N2O4(g)△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的量浓度c随时间t的变化关系如图所示. 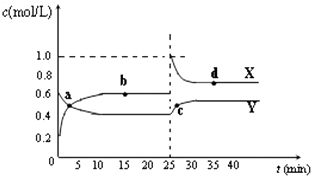
(1)a、b、c、d四个点中,化学反应处于平衡状态的是点.
(2)25min时,增加了(填物质的化学式)mol.
(3)a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是(填字母).
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( ) 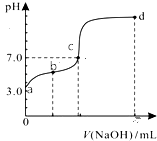
A.由题可知HA为弱酸
B.滴定终点位于c和d点之间
C.滴定到b点时:n(Na+)+n(H+)﹣n(OH﹣)+n(HA)=0.002mol
D.滴定到d点时:c(OH﹣)>c(Na+)>c(A﹣)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是( )
A.乙烯和聚乙烯的性质不同
B.聚乙烯是由—CH2—CH2—分子组成的化合物,加热至某一温度则可完全熔化
C.同质量的乙烯和聚乙烯完全燃烧后生成的CO2的质量相等
D.乙烯和聚乙烯的最简式相同
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则
(1)该反应的正反应是热反应,且m+np (填“>”、“<”或“=”).
(2)增大压强时,B的转化率(填“增大”、“减小”或“不变”,下同),逆反应速率 .
(3)若加入C(体积不变),则A的体积分数 .
(4)若降低温度,则平衡时B、C的浓度之比 ![]() 比值将 .
比值将 .
(5)若加入催化剂,该反应的反应热 .
(6)若B是有色物质,A、C均为无色物质,维持容器体积不变,充入氖气时,混合气体的颜色(填“变浅”、“变深”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,在研究新能源的前沿技术上,科学家致力于二氧化碳的“组合转化”技术的研究,把过多的二氧化碳转化为有益于人类的物质。
(1)乙烯的产量是衡量一个国家石油化工发展水平的标志之一,下列石油化工生产能提高乙烯的产量的是________。
A.蒸馏、分馏
B.催化裂化
C.催化裂解
D.催化重整
(2)下列说法不正确的是__________。
A.石油是混合物,分馏后得到的馏分是纯净物
B.煤隔绝空气加强热可以得到黑褐色油状的煤焦油
C.煤的气化和液化是使煤变成清洁能源的有效途径
D.从绿色化学角度考虑,以植物为主的生物质资源,是未来的理想资源
(3)如果将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
CO2+4H2→()+2H2O
(4)若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是________。
A.烷烃
B.烯烃
C.炔烃
D.芳香烃
(5)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
原料— 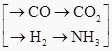 →CO(NH2)2
→CO(NH2)2
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?。
(6)请根据以上信息,设计工业合成尿素的条件。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com