
科目: 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目: 来源: 题型:







 由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得:
由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得: 请在括号中填写加工方法或操作名称
请在括号中填写加工方法或操作名称查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||
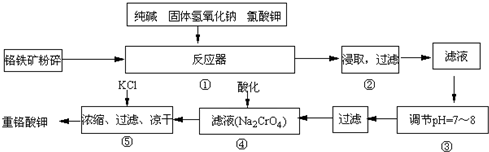
| ||
| ||
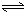 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O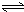 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O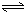 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O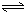 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全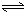 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O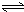 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O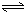 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O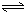 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全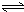 Cr2O72-+H2O
Cr2O72-+H2O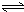 Cr2O72-+H2O
Cr2O72-+H2O查看答案和解析>>
科目: 来源: 题型:
 由1~20号元素组成的A、B、C、D、E、F有如图所示的相互转变,所有反应物和生成物均已给出,且已知A、C、D为单质,B、E、F为化合物.
由1~20号元素组成的A、B、C、D、E、F有如图所示的相互转变,所有反应物和生成物均已给出,且已知A、C、D为单质,B、E、F为化合物.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com