
科目: 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。
已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
(1)写出四种元素的元素符号:
W;X;Y;Z。
(2)四种元素的所有化合价中,最低负化合价为价,最高正化合价为价。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为;化合物乙是一种常见的化肥,其化学式为。
(4)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:。
查看答案和解析>>
科目: 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示: 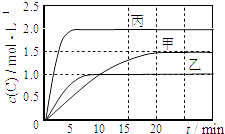
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 | 1.5molA | 1.5molA | 6.0molA |
下列说法正确的是( )
A.x=1
B.10min内乙容器中反应的平均速率v(B)=0.025molL﹣1min﹣1
C.由图可知:T1<T2 , 且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA,1.5molB,平衡时A的转化率为75%
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3 , B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为 , C中可观察到的现象是。
(2)B装置的作用是。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是 , 由此得出碳、硅、氮三种元素非金属性的强弱顺序是。
(4)实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
写出B装置中发生反应的离子方程式:。
(5)C装置的作用是。
(6)实验结论:氧化性 , 非金属性:。
查看答案和解析>>
科目: 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是( ) 
A.普伐他汀分子中有4种含氧官能团
B.每个普伐他汀分子中含有13个手性碳原子
C.在一定条件下,普伐他汀能发生加成、取代、消去、缩聚反应
D.普伐他汀可以和NaOH溶液、Na2CO3溶液反应,还可以和酸性KMnO4溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表中某区域的一些元素多能用于制半导体,它们是
A. 左下方区域的金属元素B. 右上方区域的非金属元素
C. 金属和非金属分界线附近的元素D. 稀有气体元素
查看答案和解析>>
科目: 来源: 题型:
【题目】离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( ) 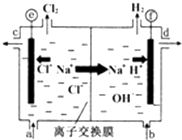
A.e电极与电源的负极相连
B.H+在f电极上发生还原反应
C.精制饱和食盐水从图中b位置补充
D.离子交换膜的作用只是防止生成的Cl2与H2发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应mA(g)+nB(g)pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v﹣t图象.下列判断正确的是( )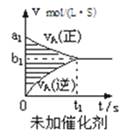
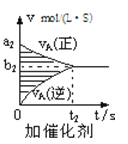
A.b1>b2 , t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.NO2与水的反应:3NO2+H2O═2H++2NO3﹣+NO
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
C.醋酸溶液与水垢中的CaCO3反应:2H++CaCO3═Ca2++H2O+CO2↑
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3﹣═Ag++NO↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)Fe(s)+CO2(g)不能自发进行,已知正反应吸热.
(l)关于化学反应方向的判据△H﹣T△S<0,反应___________(填能自发、不能自发)
答案:不能自发
(1)该反应中平衡常数的表达式 K═温度升高,化学平衡移动后达到新的平衡,平衡常数K值 . (均填增大、减小或不变)
(2)1100℃时测得高炉中 c(CO2)=0.025mol/L,c(CO)═0.lmol/L,已知1100℃时平衡常数K=0.263.在这种情况下该反应是否处于平衡状态(填是或否),此时化学反应速率是v(正)v(逆)(填=、>或<).
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO,则CO的转化率将(填“增大”、“减小”、“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)4NO(g)+6H2O(g)
(1)①该反应的熵变△S0(填“>”、“<”或“=”).
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H0(填“>”、“<”或“=”).
(2)若其他条件不变,下列关系图错误的是(选填序号).
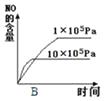


(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(molL﹣1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2min | 3.2 | 4.5 | 0.8 | 1.2 |
第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第2min到第4min时,反应速率υ(O2)=;
②反应在第2min时改变了条件,改变的条件可能是 . 该条件下,反应的平衡常数K=(只写计算结果,不标单位).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com