
科目: 来源: 题型:
【题目】下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在防毒面具中做供氧剂 ④铁丝在氯气中燃烧生成棕色的FeCl3
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,101k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
A(g)+2B(g)2C(g)+2D(l)△H=﹣250kJmol﹣1 K=0.2L/mol
(1)写出该反应平衡常数的表达式: .
(2)该反应的逆反应的△H= , 该反应的逆反应的K= .
(3)对该反应而言,升高温度,平衡常数将;增大压强,平衡常数将 . (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】茶叶中铁元素检验可用以下步骤完成,各步骤选用实验用品不能都用到的( ) 
A.将茶叶灼烧灰化,选用①、②和⑨
B.过滤得到滤液,选用④、⑤和⑦
C.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
D.检验滤液中的Fe3+ , 选用③、⑧和⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】1000ml某待测溶液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(每次实验所加试剂均过量):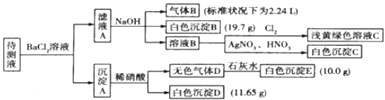
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:判断原溶液中K+是否存在(填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体: ①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是(写化学式).
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途. 请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如图1: 
①Cu2+的价电子排布图; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为(填元素符号).
②SO42﹣的空间构型为 , SO32﹣离子中心原子的杂化方式为 .
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式.
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出SO4H2O晶体. ①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因.
(4)Cu晶体的堆积方式如图2所示,设Cu原子半径为r,晶体中Cu原子的配位数为,晶体的空间利用率为(列式).
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g)2C(g)△H<0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol.回答下列问题:
(1)反应达平衡时B在平衡混合气体中的体积分数为;
(2)若反应温度升高,A的转化率;(填“增大”、“减小”或“不变”)
(3)该温度下该反应的平衡常数K=;
(4)平衡后,其他条件不变的情况下,将体积压缩到原来的 ![]() 时,对该反应产生的影响是;
时,对该反应产生的影响是;
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(5)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 .
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.体系的压强不随时间而改变
(6)若维持容器体积和温度不变,某时刻测得A、B、C的浓度分别为1mol/L、3mol/L、2mol/L,则此时该反应的正反应速率逆反应速率.(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】以电石渣为原料制备KClO3的流程如图1: 
(1)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2分解为CaCl2和O2 . ①生成Ca(ClO)2的化学方程式为;
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号).
A.适当减缓通入Cl2速率B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O氯化完成后过滤. ①滤渣的主要成分为(填化学式).
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n:n1:5(填“>”、“<”或“=”).
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3 , 若溶液中KClO3的含量为100gL﹣1 , 从该溶液中尽可能多地析出KClO3固体的方法是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是()
A.漂白粉的有效成分是Ca(ClO)2和CaCl2B.漂白粉在空气中久置后会变质
C.漂白粉的有效成分Ca(ClO)2不稳定,易分解D.漂白粉的主要成分是CaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com