在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH
2O(g)的混合气体,进行如下化学反应:CO(g)+H
2O(g)?CO
2(g)+H
2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
|
0min |
10min |
20min |
30min |
40min |
50min |
| 830℃ |
1mol |
0.8mol |
0.65mol |
0.55mol |
0.5mol |
0.5mol |
| 1100℃ |
1mol |
0.75mol |
0.6mol |
0.6mol |
0.6mol |
0.6mol |
(1)1100℃时,前10min该反应的化学反应速率v(CO
2)=
0.025mol/(L.min)
0.025mol/(L.min)
,830℃平衡后CO转化率的为
50%
50%
.
(2)1100℃时化学平衡常数K=
0.44
0.44
,该反应为
放热
放热
反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是
bc
bc
.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v
逆(H
2)=v
正(H
2O) (d)c(CO
2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH
2O(g),平衡
无此空
无此空
向正反应方向移动
向正反应方向移动
移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H
2百分含量
不变
不变
(选填“增大”或“减小”或“不变”).
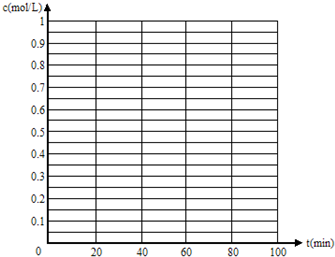
(5)830℃时,若在体积为2L的密闭容器中充入1molCO
2和1molH
2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H
2)随时间变化而变化的趋势图.

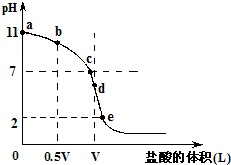 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: