
科目: 来源: 题型:
【题目】下列说法或表述正确的是( ) ①常温时pH=11的KOH溶液与pH=3的醋酸等体积混合,所得溶液pH<7
②二氧化硅是酸性氧化物,但它能与某种酸反应
③Fe2O3(s)+3H2(g)═ 2Fe(s)+3H2O(g)△H>0,△S>0任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:O2+4e﹣+4H+═2H2O
⑥H2的燃烧热为285.8kJ/mol,则表示H2的燃烧热的热化学方程式为H2(g)+ ![]() O2(g)═ H2O(g)△H=﹣285.8kJ/mol.
O2(g)═ H2O(g)△H=﹣285.8kJ/mol.
A.①④
B.①②
C.④⑥
D.③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定乙醇的结构式,有人设计了无水酒精与钠反应的实验装置和测定氢气体积的测量装置.
(1)关闭图A装置中的止水夹a,开启活塞b,液体往下滴,直至全部流入烧瓶.试判断B装置是否漏气(填“漏气”“不漏气”或“无法确定”);原因 .
(2)装置B中读数时应该使 .
(3)实验前预先将小块钠在二甲苯中融化成小钠珠,冷却后倒入烧瓶中,其目的是 .
(4)如果将此实验的数据视作标准状况下的数据,无水酒精的密度为ρ gcm﹣3 , VmL酒精反应完全后,量筒内的液面读数为m mL,则乙醇分子中能被钠取代的氢原子数可表示为 . (用含上述字母的代数式表示即可)
(5)若实验所测定的结果偏高,可能引起的原因是(填写编号).①反应完毕立刻读数
②无水酒精中混有少量甲醇
③无水酒精与钠的反应不够完全
④排水后量气装置导管内有水残留.
查看答案和解析>>
科目: 来源: 题型:
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4 . SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为mol/L.
(2)若以浓硫酸吸水后生成H2SO4 . H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).
已知空气组成:N2体积分数0.79、O2体积分数0.21.
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
阴离子 | OH﹣、Cl﹣、CO |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: .
(2)写出E溶液与过量的B溶液反应的离子方程式 .
(3)已知:NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l);△H=﹣akJmol﹣1 . 请写出B与C的稀溶液反应的热化学方程式 .
(4)在100mL 0.1 molL﹣1E溶液中,逐滴加入35 mL 2 molL﹣1NaOH溶液,最终得到沉淀的物质的量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对硫酸的叙述正确的是( )
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸不活泼,可用铁铝容器存放
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.浓硫酸难挥发,可用来制HF、HCl等挥发性酸
查看答案和解析>>
科目: 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
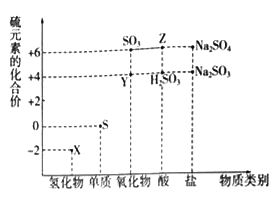
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 地壳中含量居第一位 |
Z | 短周期中其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式 .
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q,M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值).①可用Q和X的单质在800~1 000℃制得,每生成1 mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1 600~1 750℃生成QX,每消耗18 g碳生成1 mol QX,吸收b kJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式 .
(4)X、Y组成的一种无色气体遇空气变为红棕色.标准状况下将40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,某稀溶液中由水电离产生的c(OH﹣)=10﹣10 molL﹣1 . 下列有关该溶液的叙述正确的是( )
A.该溶液一定呈酸性
B.该溶液中c(H+)可能等于10﹣5 molL﹣1
C.该溶液的pH可能为4也可能为10
D.该溶液有可能呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com