
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
下列物质的分类正确的一组是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 1000m |
| 46a |
| 1000m |
| 46a |
| 142a |
| 10b |
| 142a |
| 10b |
查看答案和解析>>
科目: 来源: 题型:
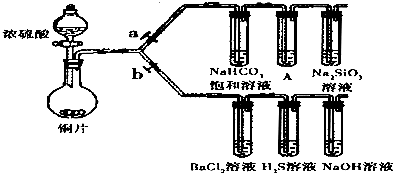
 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.| 53(w-m) |
| 22n |
| 53(w-m) |
| 22n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com