
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目: 来源: 题型:
实验题:(本题共12分)
(1)用18.4mol/L的浓H2SO4配制100ml浓度为1mol/L的稀H2SO4,其操作可分为以下各步:
A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50ml蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30ml蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中;
C.将稀释后的H2SO4小心倒入100ml容量瓶里;
D.检查100ml容量瓶口部是否会发生滴漏;
E、用量筒加蒸馏水至容量瓶中液面接近刻度2cm处;
F、盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G、用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写) 。
②进行A步操作时,应选择下列量器 (填序号)
a、10ml量筒 b、50ml量筒 c、100ml量筒
③如果对装有浓H2SO4的量筒读数如右图所示,配制的稀H2SO4的浓度
将 (偏高、偏低、无影响)
④进入A步操作后,必须 后才能进行C操作。
(2)只从下列试剂中选择实验所需的试剂,采用两种不同的方法区分0.1mol/L的H2SO4和0.01mol/LH2SO4溶液,简述其操作过程:
试剂:紫色石蕊试液、酚酞试液、甲基橙试液、蒸馏水、BaCl2溶液、pH试纸、0.1mol/L Na2S2O3溶液
方法一:
。
方法二:
。
查看答案和解析>>
科目: 来源: 题型:
 随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注.如图所示是最近研发出的天然气利用新途径:首先,甲烷在催化剂作用下发生“氧氯化反应”生成一氯甲烷;然后,一氯甲烷在400℃的条件下通过分子筛催化转化为低碳烯烃.
随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注.如图所示是最近研发出的天然气利用新途径:首先,甲烷在催化剂作用下发生“氧氯化反应”生成一氯甲烷;然后,一氯甲烷在400℃的条件下通过分子筛催化转化为低碳烯烃.| 分子筛 |
| 分子筛 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
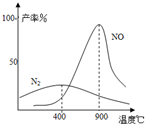 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: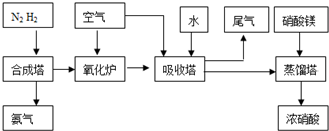
| 时间(h)浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
| 1 |
| a |
| 1 |
| a |
查看答案和解析>>
科目: 来源: 题型:



查看答案和解析>>
科目: 来源: 题型:阅读理解
| 指标 项目 |
优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
 .?
.?
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com