
科目: 来源: 题型:
【题目】在一支25 mL的酸式滴定管中盛入0.lmol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1 NaOH 溶液进行中和.则所需 NaOH 溶液的体积
A. 大于20 mL B. 小于20 mL C. 等于20 mL D. 等于5 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G[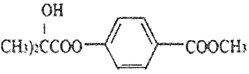 ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下:
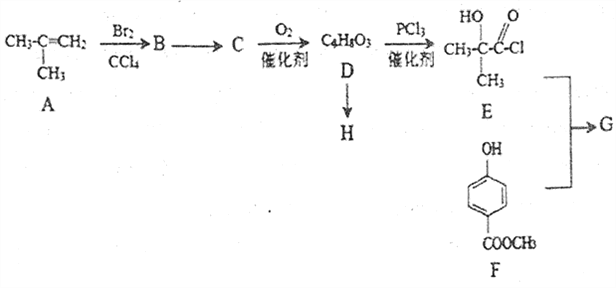
已知:RCOOH  RCOCl
RCOCl
请回答下列问题:
(1)A的同分异构体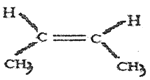 名称是_______。
名称是_______。
(2) B→C 的反应条件为_________,D→E的反应类型是________。
(3)D在浓硫酸加热的条件下会生成一种含六元环的化合物,该化合物的结构简式为______。
(4)H 是一种高聚酯,D→H 的化学方程式为________________。
(5)下列关于化合物D 和G 的说法错误的是_______。
A.在一定条件下G 能与HBr 发生取代反应
B.1molG 与NaOH 溶液加热最多消耗2molNaOH
C.D 的分子中只有一个手性碳原子
D.与D具有相同的官能团的同分异构体还有3种
(6)符合下列要求的F 的同分异构体共有______种
①苯环上有三个取代基 ②能发生银镜反应 ③1mol 物质能与2mo1Na2CO3反应
请写出其中能与足量浓溴水反应,所得产物的苯环上不存在氢原子的F 的同分异构体结构简式__________(任写一种)
(7)已知酚羟基不易与羧酸发生酯化反应,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯(![]() )的合成路线(其它试剂任选)。___________
)的合成路线(其它试剂任选)。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2![]() 2UF4·NH4F+3NH3↑+4H2O↑
2UF4·NH4F+3NH3↑+4H2O↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
②物质 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C原子的配位数为______。该晶体硬度超过金刚石的原因是_________。
②已知该晶胞的密度为dg/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为_______(用含d、r1、r2、NA的代数式表示,不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为______。
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为______,如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式______________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式_______________________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是________________。

利用化学平衡移动原理分析低于或高于最优温度时,MoS3的产率均下降的原因:_______________________。
(5)MoO3·H2O作为高能非水体系电池的正极材料优于一般新型材料,某电池反应为: MoO3·H2O+xA=AxMoO3·H2O (某文献记载:式中0+为Li+、H+、K+、Na+等。A+的注入使得部分Mo6+还原为MO5+),写出该电池以金属锂为负极,充电时的阳极反应式:__________________。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8)钼酸钠晶体(NaMoO4·2H20)是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMo04开始沉淀时,溶液中的c(MoO42-)/c(SO42-)____(結果保留2位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:

①包装:取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温。然后放入称量瓶中称量,质量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量:萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中使用了三次的仪器X的名称___________。为提高乙醚蒸气的冷凝效果,索氏提取器可选用下列______(填字母)代替。
a. 空气冷凝管![]() b.直形冷凝管
b.直形冷凝管![]()
C.蛇形冷凝管![]()
(2)①实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为___(填字母)。
a.活性炭 b.碱石灰 c:P2O5 d.浓硫酸
②无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是______________________。
(3)①实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_____。
②当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为________。
A.冷凝回流 B.虹吸 C.倒吸 D.分液
③索氏提取法与一般萃取法相比较,其优点为_______________。
(4)数据处理: 样品中纯脂肪百分含量_______(填“<”、“>”或“=”)![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg(OH-) 变化的关系如图所示。下列叙述错误的是

下列叙述错误的是
A. Kb1(N2H4)=10-6
B. 反应N2H62++N2H4=2N2H5+的PK=9.0 (已知:pK=-1gK)
C. N2H5C1溶液中c(H+)>c(OH-)
D. N2H5C1溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列举了部分元素在自然界和人体内的质量分数(%),下面的说法不正确的是( )
C | H | O | Fe | Ca | |
地壳 | 0.19 | 0.22 | 47 | 4.5 | 3.5 |
人体 | 9.4 | 63 | 25.5 | 0.01 | 0.31 |
A. 上表体现了生物界与非生物界的统一性
B. 上表体现了生物界与非生物界的差异性
C. 上表中列举的化学元素都是生命所必需的大量元素
D. 上表中列举的C、H、O、Fe、Ca是人体所必需的化学元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com