
科目: 来源: 题型:
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )
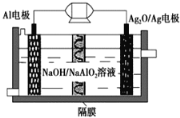
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C. Al电极做负极,电极反应式为:Al-3e-=Al3+
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目: 来源: 题型:
【题目】硅芯片是各种计算机、微电子产品的核心.工业上通过以下反应将自然界的二氧化硅转化为硅:SiO2+2C ![]() Si+2CO↑,下列针对该反应的分析不正确的是( )
Si+2CO↑,下列针对该反应的分析不正确的是( )
A.属于置换反应
B.碳发生了还原反应
C.二氧化硅是氧化剂
D.24g碳充分反应生成28g硅
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
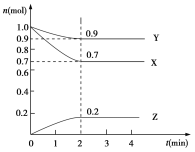
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________________________。
(3)当反应进行到第___min,该反应达到平衡。此时,v(正)____v(逆) (填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于1.5mol NH3的说法错误的是( )
A.摩尔质量为17 gmol﹣1
B.所含的分子数目约为9.03×1023
C.在标准状况下体积约为33.6L
D.溶于水制成0.5L溶液时物质的量浓度为1.5molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味、遇水反应生成一种氯化物和两种氮化物。某学习小组在实验空用Cl2和NO制备ClNO并测定其纯度,相关实验装置(夹持装置略去)如下图所示。请回答:

(1)制备C12发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式:____________。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→_______(按气流方向,用小写字母表示)。
(3)实验室可用下图装置制备亚硝酰氯(C1NO):
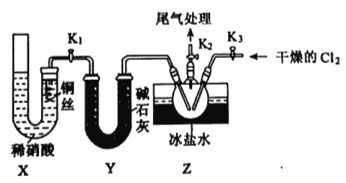
①实验室也可用B装置制备NO,X装置的优点为__________。
②检验装置气密性并装入药品,打开K2,然后再打开K1,通入一段时间气体,其目的为_______,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中C1NO可能发生反应的化学方程式为________。
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(C1NO)的质量分数为______(用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(K2CrO4)=1×10-12]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com