
科目: 来源: 题型:
【题目】某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.

(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的__ (填“正极”或“负极”),并写出B极发生反应的电极反应式__.
(2)电解开始一段时间后,在U形管中可观察到的现象__.并写出该电解反应总的离子方程式__.
(3)实验中还需测定的数据是__(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:__(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为__.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
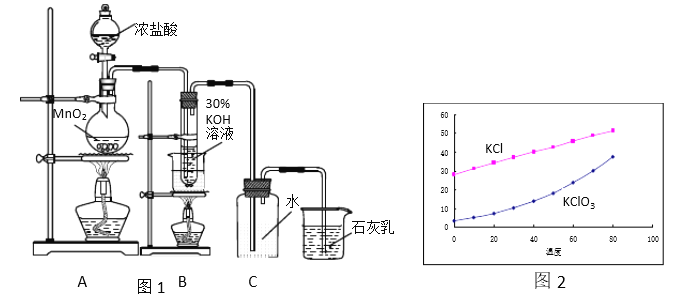
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】酯可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

(1)试管a中生成乙酸乙酯的化学方程式是________________________________。
(2)试管b中盛放的试剂是饱和_________________溶液。
(3)实验开始时,试管b中的导管不伸入液面下的原因是___________________。
(4)若分离出试管b中生成的乙酸乙酯,需要用到的仪器是______(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
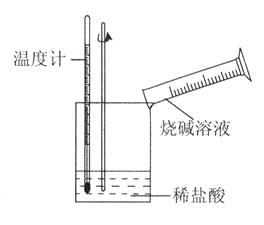
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是____________________________,正极的电极反应式是_________________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。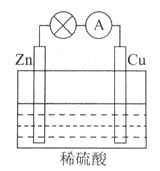
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g) ![]() 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g) ![]() CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是( )
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是( )
a.各物质的浓度不变
b.容器内气体压强不变
c.容器内气体密度不变
d.容器内气体颜色不变
e.各组分的物质的量分数或质量分数不变
A.abc
B.ade
C.ac
D.ae
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
(1)CO2的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是K=______。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
(4)有利于提高CO2转化为CH3OH平衡转化率的措施有____。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)及其化合物被广泛应用在除草剂、杀虫剂以及含砷药物中。已知砷元素位于周期表中的第四周期第ⅤA族。
(1)As元素最低价态对应的氢化物M的化学式是________。
①请任选另一种氢化物比较它与M的热稳定性(均用化学式表达)__________。
②M具有极强的还原性,可与AgNO3溶液反应产生黑色的Ag和As2O3,该反应可以用来检验微量砷,该反应的化学方程式是____________。
(2)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式:_____。
(3)As2S3和HNO3反应如下:As2S3+10H++10N![]() ==2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在__(填“正极”或“负极”)附近逸出,该极的电极反应式是__。
==2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在__(填“正极”或“负极”)附近逸出,该极的电极反应式是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.放热反应在任意条件下都能自发进行
B.已知热化学方程式2A(g)+B(g) ![]() 2C (g)△H=-QkJ/mol (Q >0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量
2C (g)△H=-QkJ/mol (Q >0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量
C.1mol/L的盐酸与1mol/L的氨水、11mol/L的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多
D.BaCl2溶液中加过量H2SO4 , 溶液中一定不存在Ba2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com