
科目: 来源: 题型:
【题目】 230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
A.Th元素的质量数是232
B.230Th和232Th的化学性质相同
C.232Th转化成233U是化学变化
D.Th元素的相对原子质量是231
查看答案和解析>>
科目: 来源: 题型:
【题目】镍、铂、镧等过渡金属单质及化合物在医疗领域有广泛的应用。
(1)基态原子镍的价电子排布式为_____。
(2)抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。
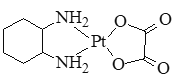
①分子中氮原子轨道的杂化类型是_____,C、N、O三种元素的第一电离能由大到小的顺序为_____。
②1 mol 乙二酸分子中含有σ键的数目为_____。
(3)碳酸镧[La2(CO3)3]用于治疗高磷血症。
①写出与CO![]() 互为等电子体的一种分子的化学式_____。
互为等电子体的一种分子的化学式_____。
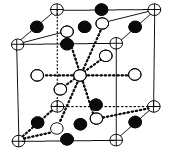
②镧镍合金可用于储氢,储氢后晶体的化学式为LaNi5(H2)3,其最小重复结构单元如图所示(![]() 、
、![]() 、
、![]() 代表晶体中的三种微粒),则图中
代表晶体中的三种微粒),则图中![]() 代表的微粒是_____。
代表的微粒是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于能量转换的认识不正确的是( )
A.电解水生成氢气和氧气时,电能转化为化学能
B.白炽灯工作时,电能全部转化为光能
C.煤燃烧时,化学能主要转化为热能
D.绿色植物的光合作用时,将光能转变为化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现用该浓硫酸配制450 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有______________(写仪器名称);
(2)经计算,欲配制450 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为____mL,量取浓硫酸时应选用____规格的量筒;
A.10 mL B.50 mL C.100 mL D.200 mL
(3)在烧杯中稀释浓硫酸的实验操作为_____________________________。
(4)在配制过程中,若用量筒量取浓硫酸时,俯视刻度线,会使所配溶液浓度_________;若转移溶液时,不慎有少量溶液洒出,会使所配溶液浓度_________,若定容时,俯视容量瓶刻度线,会使所配溶液浓度_________(填“偏大、偏小、无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
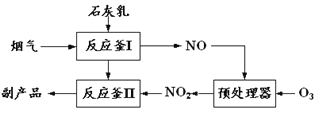
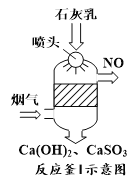
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是_____。
②反应釜II中CaSO3转化为CaSO4的化学反应方程式为_____。
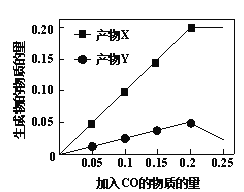
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是____。
(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是_____。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是______。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
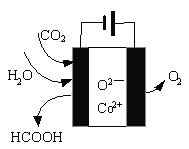
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是
A.该晶体属分子晶体B.该分子内原子间都以极性共价键相连接
C.该物质是一种新化合物D.该物质的相对分子质量为2400
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
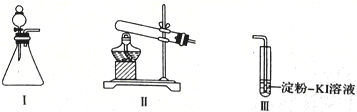
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
供选试剂:30%H2O2溶液、O.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向Ⅲ的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×l0-3)制备FePO4流程如下:

(1)“溶解”时H3PO4不宜过量太多的原因是___。
(2)①写出“反应”时总反应的离子方程式:____。
②证明“反应”后铁元素沉淀完全的实验方法是___。
(3)①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是____。
②洗涤FePO4沉淀的操作是 ___。
(4)FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近l00℃时易失去结晶水。相关物质的溶解度曲线如图所示。
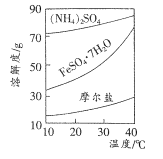
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入____。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com