
科目: 来源: 题型:
【题目】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
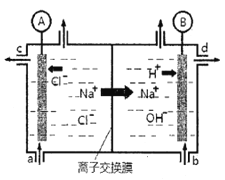
完成下列填空:
①写出电解饱和食盐水的离子方程式_________。
②离子交换膜的作用为:__________、__________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
(2)已知在强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-。
①此反应的离子方程式是_________。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______.
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH____7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=_________。
(3)向2份0.1mol/LCH3COONa溶液中分别加人少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为_____、______ (填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴阳离子总浓度大小, NaA_______NaB (填">”、“<”或“=")。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+沉淀完全的pH为____。(Ksp[Fe(OH)3]=4×10-38,1g2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=______;若降低温度,K值将______(填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
(3)达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是_______ (填序号)。
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2

(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x____y(“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容密闭容器中发生反应: A(s) +2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于氮的固定的是( )
A.空气在雷电作用下产生一氧化氮B.一氧化氮和氧气反应生成二氧化氮
C.铜与浓硝酸反应产生二氧化氮D.氯化铵与氢氧化钙反应生成氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com