
科目: 来源: 题型:
 (2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:
(2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
查看答案和解析>>
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:阅读理解
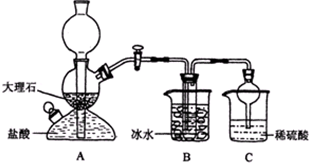 (2009?清远模拟)某校学生在实验室中设计了如下装置,模拟侯德榜制碱法,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,再将碳酸氢钠晶体加热分解而制得碳酸钠晶体,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(2009?清远模拟)某校学生在实验室中设计了如下装置,模拟侯德榜制碱法,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,再将碳酸氢钠晶体加热分解而制得碳酸钠晶体,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目: 来源: 题型:
 (2009?清远模拟)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用右图中的实验装置进行实验,证明过氧化钠可作供氧剂.
(2009?清远模拟)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用右图中的实验装置进行实验,证明过氧化钠可作供氧剂.| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl 除去CO2气体中混入的HCl |
| C | 过氧化钠 过氧化钠 |
与CO2和水气反应,产生O2 与CO2和水气反应,产生O2 |
| D | NaOH溶液 NaOH溶液 |
吸收未反应的CO2气体 吸收未反应的CO2气体 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(2009?清远模拟)在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300°C,经充分反应后排出气体,则残留固体及其物质的量正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(2010?汕头一模)根据下列实验现象,所得结论正确的是:( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com