
科目: 来源: 题型:
| 22.4a |
| 3 |
| 22.4a |
| 3 |
| x |
| 2 |
| x |
| 2 |
查看答案和解析>>
科目: 来源: 题型:











| 燃烧有机物的质量 | 实验方法 | 实验前后①-④装置质量 | |||
| 实验前 | 实验后 | ||||
| 甲组 | 5.4g | A | ①150g | ①153.6g | |
| ②150g | ②165.4g | ||||
| 乙组 | 5.4g | B | ③150g | ③166.0g | |
| ④150g | ④154.2g | ||||
查看答案和解析>>
科目: 来源: 题型:
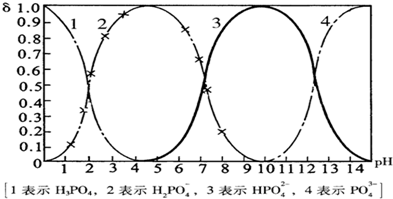
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
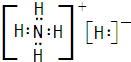
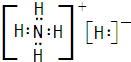
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
 (2011?常州三模)已知可逆反应:A(s)+2B(g)?C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
(2011?常州三模)已知可逆反应:A(s)+2B(g)?C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com