
科目: 来源: 题型:
在0℃、1.01×105帕条件下,a克气体X与b克气体Y 的分子数相同,下列说法错误的是( )
A.标准状况下等质量X和Y的体积比是b:a
B.同温同压下气体X和气体Y的密度比是b:a
C.250C时1克气体X和l克气体Y的分子数之比是b:a
D.同物质的量气体X和气体Y的质量比是a:b
查看答案和解析>>
科目: 来源: 题型:
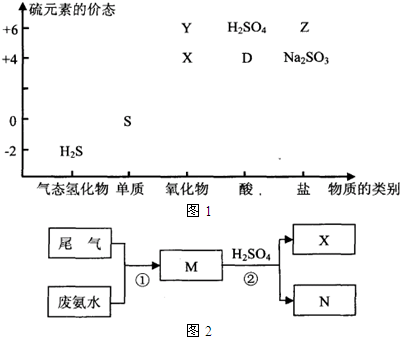
| ||
| H+ |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量待测液,加入AgNO3溶液 | 有白色沉淀生成 | 待测液中Cl-离子 不能确定 不能确定 (填“一定存在”、“一定不存在”或“不能确定”) |
| ②取100mL待测液,加足量浓NaOH溶液并加热 | 收集到气体约1.12L (已折算成标准状况下的体积) |
反应的离子方程式是 NH4++OH-  NH3↑+H2O NH3↑+H2ONH4++OH-  NH3↑+H2O NH3↑+H2O检出离子的物质的量浓度是 0.5mol/L 0.5mol/L |
| ③取100mL待测液,加足量BaCl2溶液后,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量白色沉淀质量为6.27g,第二次称量白色沉淀质量为2.33g | - |
| 实验分析:根据实验①~③,可判断待测液中一定存在的离子除K+离子外,还有的离子是 NH4+、CO32-、SO42- NH4+、CO32-、SO42- .判断K+离子存在的理由是 数据计算n(NH4+)=0.05mol,n(CO32-)=0.02mol,n(SO42-)=0.01mol 根据溶液中阴阳离子电荷守恒CO32-和SO42-所带负电荷总数大于NH4+所带正电荷总数 数据计算n(NH4+)=0.05mol,n(CO32-)=0.02mol,n(SO42-)=0.01mol .根据溶液中阴阳离子电荷守恒CO32-和SO42-所带负电荷总数大于NH4+所带正电荷总数 | ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
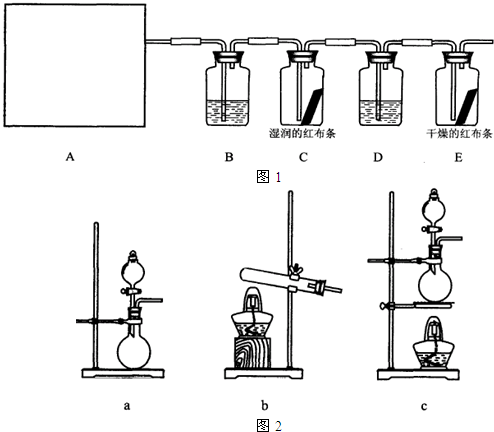
查看答案和解析>>
科目: 来源: 题型:
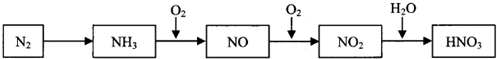
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:
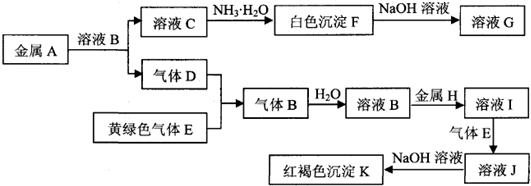
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com