
科目: 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应方程式书写不正确的是
A. 用氢氟酸雕刻玻璃:SiO2+4HF=SiF4↑+2H2O
B. 工业上用电解法制镁:MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
C. 将铝片打磨后放入氢氧化钠溶液中:2Al+2OH﹣=2AlO2-+H2↑
D. 氢氧化亚铁暴露于空气中:4Fe(OH)2 +O2 +2H2O=4Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】没食子酸丙酯简称PG,结构简式为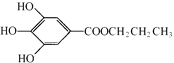 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
(1)PG的分子式为___________,请写出PG分子中所含官能团的名称___________,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是___________。
PG可发生如下转化:

(2)A的结构简式为___________,1mol没食子酸最多可与___________mol H2加成.
(3)上图的有关变化中,属于氧化反应的有___________(填序号)。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是___________(填序号)
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为:___________。
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:___________
i.含有苯环,且苯环上的一溴代物只有一种; ii.既能发生银镜反应,又能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃时,该电离平衡的平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代数式表示)。[提示:此时电离度比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为b mol·L-1,则此时c2(H+)=____________________mol·L-1(用含a、b的代数式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
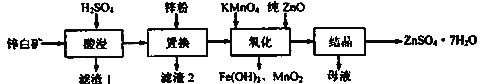
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生氧化还原反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是_______________________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
(5)ZnSO4 ·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是_______
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】制备纯净的液态无水四氯化锡的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
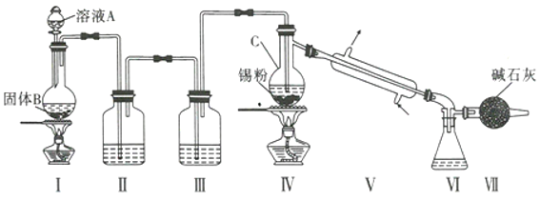
回答下列问题:
(1) Sn在元素周期表中的位罝为____________________________。
(2) Ⅱ、Ⅲ中的试剂分別为_______、__________;Ⅶ的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是_________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的_________。
A.用石斧解剖 B.早期的农业耕作
B.早期的农业耕作
C.简单机械织布![]() D.祥云火炬燃烧
D.祥云火炬燃烧![]()
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
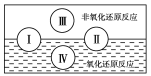
试写出一个有水生成的属于类型Ⅲ的化学方程式_________;
有水参加的反应:C+H2O(g)![]() CO+H2,符合图中反应类型______(填标号)。
CO+H2,符合图中反应类型______(填标号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com