
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
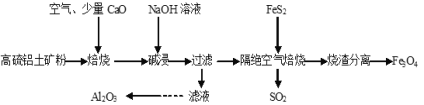
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
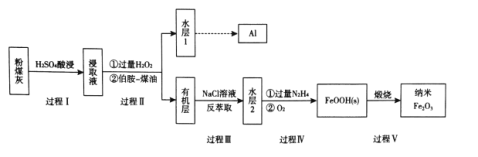
已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-
[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____。
(2)过程II加入过量H2O2的作用是 ___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
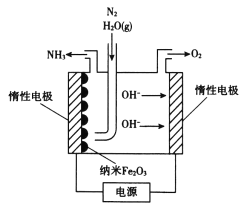
已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____,
第二步:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,则此反应的化学平衡常数为1/40
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列几组物质中,互为同位素的是_______,互为同素异形体的是_______,互为同系物的是_______,互为同分异构体的是_______,属于同种物质的是_______。(用序号填空)
①O2 和O3 ②35Cl 和 37Cl ③CH3CH3 和 CH3CH2CH3④ 和
和 ⑤CH3(CH2)2CH3 和(CH3)2CHCH3
⑤CH3(CH2)2CH3 和(CH3)2CHCH3
(2)硫酸的性质有:A.高沸点;B.酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①实验室干燥氢气_____;
②浓硫酸与金属铜的反应_____;
③浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_____
(3)已知氯有 2 种常见同位素原子 35Cl、37Cl,氢有 3 种常见的同位素原子 H、D、T,氯气与氢气形成的氯化氢分子的相对分子质量可能有_____种。
(4)质量相同的 H2 16O 和 D2 16O 所含质子数之比为_____
(5)①CO2 ②CH3CH3 ③CaBr2 ④H2O2 ⑤NH4Cl ⑥AlCl3 ⑦NaOH ⑧NH3 ⑨Na2O2试用以上编号填空:既有极性键,又有非极性键的是_____;属于离子化合物的是_____;
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度、压强下的气体摩尔体积为55.20 L·mol-1,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)![]() mY(g)+Z(g),测得混合气体中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡时混合气体的平均相对分子质量为
mY(g)+Z(g),测得混合气体中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡时混合气体的平均相对分子质量为
A. 58.80 B. 46.00
C. 39.74 D. 16.13
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铝是某种高效净水剂的主要成分,实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3、SiO2等杂质)制取碱式氯化铝的过程如下:
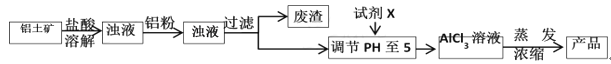
(1)溶解铝土矿需要使用质量分数为15%的盐酸,配制该盐酸所需的玻璃仪器有________
(2)盐酸溶解铝土矿的过程中,发生反应的离子方程式为____________(写一个即可),其目的是__________________________________________________________。
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为__________(填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,________________________________________________,得出被测液的pH。
(5)实验室利用盐酸与大理石制取CO2的实验装置如图所示:
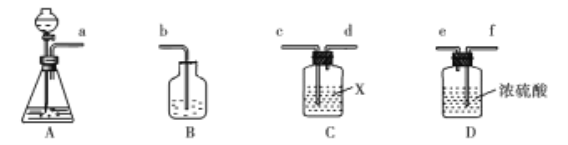
则各装置中导管从左到右的连接顺序为_________,装置C中盛放的试剂X为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8 L,则该气体的摩尔体积为____________。
(2)有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,③3.4 g H2S,④0.2 mol NH3,则其体积按从大到小的顺序为:_________________(填序号)。
(3)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为__________
(4)实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是___________。
(5)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是__________(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用bmol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________________。
(2)滴定操作时,左手控制滴定管,右手__________,眼睛要注视__________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由__________色变为__________色。
(4)水中溶解氧的计算式是__________(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果__________(填“偏高”“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
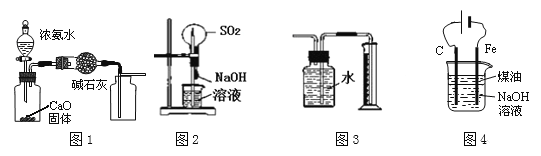
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可以完成“喷泉”实验
C.用图3装置直接测量Cu与浓硝酸反应产生的NO2体积
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 | 元素性质与原子(或分子)结构的相关信息 |
T | 最外层电子数是次外层电子数的 3 倍 |
X | 常温下单质分子为双原子分子,分子中含有 3 对共用电子对 |
Y | M 层比K 层少 1 个电子 |
Z | 其离子是第三周期金属元素的离子中半径最小的 |
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com