
科目: 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

请回答:
(1)常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 ________。
 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. Fe与S混合加热生成FeS2
B. NaHCO3的热稳定性大于Na2CO3
C. 过量的铜与浓硝酸反应有一氧化氮生成
D. 白磷在空气中加热到一定温度能转化为红磷
查看答案和解析>>
科目: 来源: 题型:
【题目】物质X的结构简式如图所示,它常被用于制香料或作为饮料酸化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是

A. 与X具有相同官能团,且分子中有4种不同化学环境的氢原子的X的同分异构体有3种
B. X分子内所有碳原子可能在同一平面内
C. 不能发生氧化反应,能发生取代反应
D. 1molX与足量的Na反应可生成44.8LH2
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,r 溶于水是强酸,s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )

A.W 在周期表中所在族全是金属B.X 的最高价氧化物的水化物为强酸
C.Y 的氢化物常温常压下为气态D.1molZ 单质与氢氧化钠溶液反应转移 1mol 电子
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是( )

A. OA段的反应离子方程式为:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B. AB段的离子方程式只有:Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
C. A点的沉淀为Al(OH)3和BaSO4的混合物
D. B点溶液为KAlO2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:
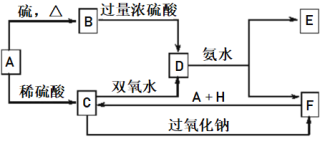
已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)写出C的溶液与双氧水反应的离子方程式:_________________。
(2)写出鉴定E中阳离子的实验方法和现象:________________。
(3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。
(4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目: 来源: 题型:
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com