Ⅰ:明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化 铝和少量氧化铁杂质.具体实验步骤如图一所示:
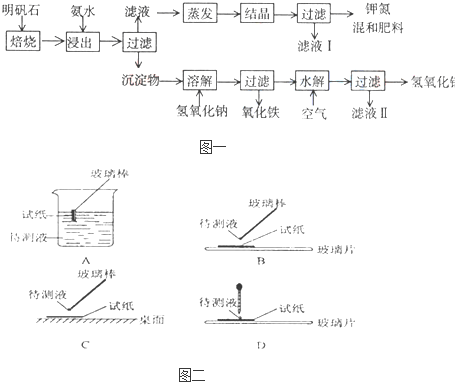
根据图一示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每 升含有250.28g氨)
78
78
mL,用规格为
100
100
mL量筒量取.
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K
+、SO
42-外,还有大量的NH
4+.检验NH
4+的方法是
取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝
取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝
.
(3)写出沉淀物中所有物质的化学式
Al(OH)3、Al2O3、Fe2O3
Al(OH)3、Al2O3、Fe2O3
.
(4)滤液I的成分是水和
K2SO4、(NH4)2SO4
K2SO4、(NH4)2SO4
.
(5)为测定混合肥料K
2SO
4、(NH
4)
2SO
4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量
BaCl2或Ba(NO3)2
BaCl2或Ba(NO3)2
溶液,产生白色沉淀.
②
过滤
过滤
、
洗涤
洗涤
、
干燥
干燥
(依次填写实验操作名称).
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K
2SO
4的物质的量为:
mol(用含m、n的代数式表示).
Ⅱ:某无色透明溶液可能含有下列离子:K
+、Al
3+、Fe
3+、Ba
2+、NO
3-、SO
42-、HCO
3-、Cl
-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕 色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失.
请回答下列问题:
( l )在实验 ①中,图二所示的操作中正确的是
BD
BD
(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是
Al3+、NO3-、SO42-
Al3+、NO3-、SO42-
,肯定不存在的离子是
Fe3+、Ba2+、HCO3-
Fe3+、Ba2+、HCO3-
.
(3)写出与②③两个实验有关的离子方程式:
②
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
;
③
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
.

