
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液不显色
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的且操作正确的是

A. 用图a所示装置配制100mL0.100mol·L-1稀盐酸
B. 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体
C. 用图c所示装置制取少量CO2气体
D. 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目: 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是
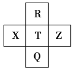
A.气态氢化物的酸性:R>T>Q
B.R与Q的电子数相差16
C.气态氢化物的稳定性:T>X
D.R的单质通入T的钠盐溶液中能置换出T的单质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 碳氢质量比为3:1的有机物一定是甲烷
D. 处在不同化学环境中的氢原子在核磁共振氢谱图上出现的位置不同
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 10g 46%的乙醇水溶液中所含氢原子数目为0.6NA
B. 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 标准状况下,2.24LCH2Cl2含有分子的数目为0.1NA
D. 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2﹣、CO32﹣、SO42﹣中的若干种离子组成,取该溶液进行如下实验:
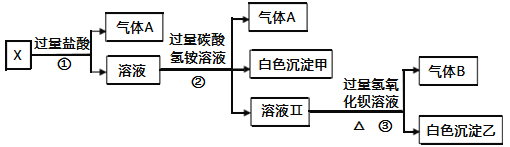
(1)气体A的成分是________(填化学式,下同),气体B的成分是________。
(2)写出步骤①发生反应的所有离子方程式________________________。
(3)写出步骤②形成白色沉淀甲的离子方程式________________________。
(4)通过上述实验,可确定X溶液中一定存在的离子是________,尚未确定是否存在的离子是________,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有以下物质相互转化:
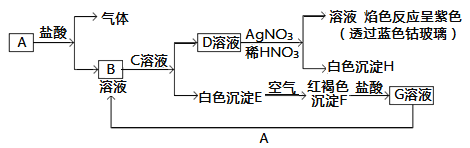
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________________________。
(3)写出用KSCN鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子反应方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为________,含有的化学键类型为_________________。
(2)生成物中含有一个10个电子的分子,该分子的空间构型为________,中心原子的杂化方式为________。
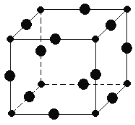
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是________(填微粒符号)。
(4)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。则一个晶胞中Al原子的数目为________个。
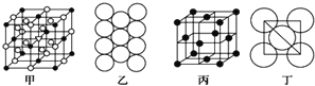
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第________周期________族。
(2)C、N、O三种元素的第一电离能由大到小的顺序为________________。
(3)Cu+的电子排布式为________________________,其在酸性溶液中不稳定,可发生歧化反应生成Cu 2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O________________________________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中H﹣C﹣O的键角________乙醇分子中的H﹣C﹣O的键角(填“大于”、“等于”或“小于”)。
(5)[Cu(H2O)4]2+中的两个H2O被Cl-取代有两种不同的结构,则[Cu(H2O)4]2+的结构为________形。
(6)Cu3N的晶胞结构如图,N3﹣的配位数为________,Cu+半径为a pm,N3﹣半径为bpm,Cu3N的密度________________g/cm3。(阿伏加德罗为常数用NA表示)(1pm=10﹣10 cm)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验过程中对应的变化与右图相符合的是
实验过程 | X | Y |
| |
A | 稀HCl滴加到NaOH溶液中 | V(HCl) | N(Na+) | |
B | 铁粉加入 CuSO4溶液中 | m(Fe) | m(固 体) | |
C | CO2通入NaOH溶液中 | V(CO2) | 溶液的导电能力 | |
D | 稀H2SO4滴加到 Ba(OH)2溶液中 | V(H2SO4) | 溶液的导电能力 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com