
科目: 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体CO2的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一。
已知:①H2和CH4的燃烧热分别为285.5kJ/mol和890.0kJ/mol。
②H2O(1)=H2O(g) ΔH=+44kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式__。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1=__,此时n2=3.则反应I的平衡常数Kp=__(无需带单位,用含总压p的式子表示。已知:气体各组分的分压p(B),等于总压乘以其体积分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。

(4)用活性炭还原法可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是__填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
F.适当升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目: 来源: 题型:
【题目】某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应。它们之间的转化关系如下图所示:

(1)A的结构式为___; F的结构简式为___;D中官能团的名称为___。
(2)反应①的反应类型是____,反应③的化学方程式为________。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中 (如图所示)。

重复操作2-3次,观察到的现象是___,该反应的化学方程式为______。
(4)B和D在浓硫酸的作用下实现反应④,实验装置如下图所示:

实验开始前饱和X溶液的溶质是_________;
饱和X溶液的作用是:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
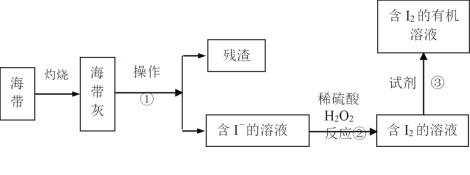
(1)操作①的名称是_________;反应②的离子方程式是____________,
(2)下述物质中可做试剂③的是_______。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
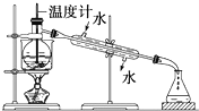
(3)从含I2的有机溶液中提取碘和回收有机溶剂(碘的沸点为184℃,该有机溶剂的沸点为77℃),需要经过蒸馏,指出下面蒸馏装置图的错误之处(其中一处即可):______。纠正错误后再进行蒸馏操作,最后晶体I2在________里聚集。
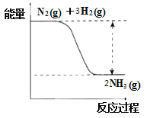
(Ⅱ)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(4)合成氨的反应中的能量变化如下图所示。该反应是_________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_________(填“大于”或“小于”)生成物化学键形成放出的总能量。
(5)在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是___(填序号)。
A.容器中N2 、H2 、NH3共存
B.N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D.容器中的压强不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+3B(g) =2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目: 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
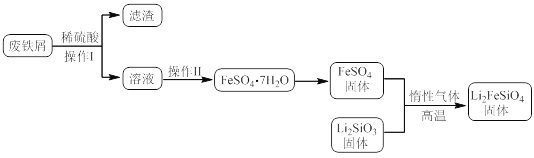
实验(二)Li2FeSiO4含量测定:
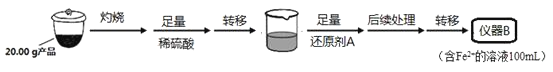
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B__,仪器C__。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是__。
(3)操作Ⅱ的步骤__,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需__。
(4)还原剂A可用SO2,写出该反应的离子方程式__,此时后续处理的主要目的是__。
(5)滴定终点时现象为__;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为_。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物分子结构式如下图,下列说法正确的是( )
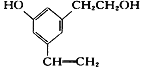
A. 取少量该有机物,滴加酸性高锰酸钾溶液,微热,有气体产生
B. 所有的碳原子不可能处在同一个平面上
C. 所有的氧原子不可能同时处在苯环平面上
D. 所有的氢原子有可能同时处在苯环平面上
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学一有机化学基础](13分)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX 可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

① B 的苯环上存在2 种不同化学环境的氢原子,则B 的结构简式是 。
② D 分子所含官能团是 (填名称)。
③ C 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)F 是B 的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应。
写出F 与NaHCO3溶液反应的化学方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N-N吸收193 kJ热量,生成1 mol N≡N放出941 kJ热量。根据以上信息和数据,下列说法正确的是( )

A. N4属于一种新型的化合物
B. N4是N2的同位素
C. N4转变为N2是物理变化
D. 1 mol N4气体转变为N2放出724 kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com