
科目: 来源: 题型:
【题目】露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积的关系如图所示(不考虑CO2在水中的溶解)。
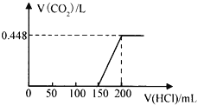
(1)写出 0~150mL 段发生反应的离子方程式为:____________;150mL ~200mL段发生反应的离子方程式为:___________________;
(2)所用盐酸的物质的量浓度为_______________;
(3)将上述氢氧化钠固体样品溶于水,所形成溶液的溶质为___________、_________(写化学式),其物质的量分别为 ____________、_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。KClO4中氯元素的化合价是_________,具有_________(填“还原性”或“氧化性”);Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做_________(填“还原剂”或“氧化剂”)。
(2)甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe粉和稀H2SO4 , B管中是NaOH溶液,请回答下列问题:
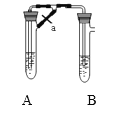
①同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是____________写出B中发生反应的所有离子方程式:___________________
②同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是__________ ;
③同学乙打开a的目的______________,根据以上实验判断___________(填甲或乙)同学可成功。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中加入一定量的A(s)和B(g),进行如下可逆反应:A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
A. ①⑤B. ③⑤C. ②④D. ①④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。人工固氮最主要的方法是Haber—Bosch法。通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
在Fe催化剂作用下的反应历程为(*表示吸附态):
化学吸附:N2(g)→2N* ;H2(g)→2H*;
表面反应:N*+H*NH*;NH*+H*NH2*;NH2*+H*NH3*;
脱附:NH3*NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)已知合成氨反应中生成1 mol NH3放出46kJ热量,该反应的热化学方程式为______
(2)实际生产中,原料气中N2和H2物质的量之比为1:2.8。分析说明原料气中N2过量的理由________。
(3)关于合成氨工艺的下列理解,正确的是____________。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.原料中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防止催化剂中毒和安全事故发生
(4)已知反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)标准平衡常数
H2(g)NH3(g)标准平衡常数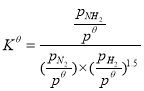 ,其中
,其中![]() 为标准压强(1×105Pa),
为标准压强(1×105Pa),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如:
为各组分的平衡分压,如:![]() =
=![]() ,p为平衡总压,
,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数。
为平衡系统中NH3的物质的量分数。
若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为![]() ,则
,则![]() =_________(用含
=_________(用含![]() 的最简式表示)。
的最简式表示)。
(5)常温常压下电解法合成氨的原理如图所示:
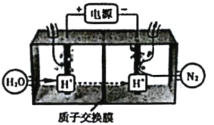
①阴极生成氨的电极反应式为__________。
②阳极产物只有O2,电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,结合电极反应式解释原因:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。下列说法错误的( )
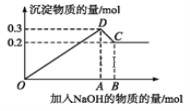
A.C点溶液中溶质为偏铝酸钠和氯化钠
B.原溶液中Mg2+、Al3+的物质的量浓度之比为 2∶1
C.C点加入0.8mol NaOH
D.图中线段OA∶AB=5∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是
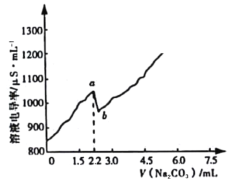
A.a点对应的溶液中Ca2+开始形成沉淀,溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
D.右图可以说明CaCO3在溶液中存在过饱和现象
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。

已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s) +2Cl-(aq)[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com