
科目: 来源: 题型:
【题目】已知偶氮化合物茜草黄(![]() )是常用植物染色剂和消炎类药物,其一种合成路线如图:
)是常用植物染色剂和消炎类药物,其一种合成路线如图:
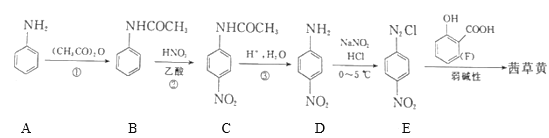
(1)茜草黄中含氧官能团的名称为___,E的分子式为___。
(2)已知A的系统名称为苯胺,则D的名称为___,①的反应类型为___;写出反应②的化学方程式:___。
(3)1molC与NaOH溶液混合,最多消耗___molNaOH;已知一NH2和一OH对苯环有相似的影响作用,请写出A遇浓溴水发生的化学反应方程式为___。
(4)写出符合下列条件的F的所有同分异构体:___,其中核磁共振氢谱吸收峰最少的有___种。
①芳香族类化合物;②在酸或碱性环境下均可水解;③可以和甲醛发生缩聚反应
(5)参照上述合成路线,设计一条以对甲基苯胺和苯酚及必要试剂合成偶氮化合物![]() 的路线:___。
的路线:___。
查看答案和解析>>
科目: 来源: 题型:
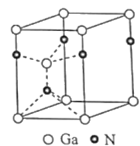
【题目】氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___,其中电子能量最高的能级是___。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___,其中C和N的杂化方式均为___HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___区,该环状配离子的配位原子为___。
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___(选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶体的密度为___gcm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
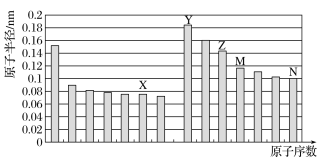
A.M在周期表中的位置为:第三周期,IV族
B.Y和N形成的化合物为离子化合物
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上研究高效处理煤燃烧释放出来的SO2,有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃时:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=___。
(2)在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=___,SO2的平衡转化率![]() (SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
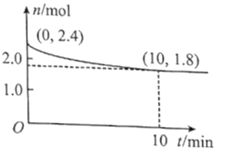
(3)实验测得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),![]() 的值将___(填“增大”、“减小”或“不变”)。
的值将___(填“增大”、“减小”或“不变”)。
(4)某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为___;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是___;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是___。
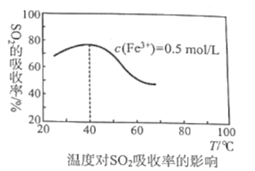
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10.00mL浓度均为0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;巳知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NHH2O]=l.60×l0-4。下列说法正确的是( )
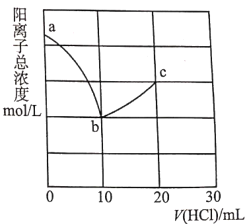
A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L
B.从a到c的过程中,水的电离程度最大的是b点
C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-)
D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NHH2O]
查看答案和解析>>
科目: 来源: 题型:
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确是
A.上述反应涉及到的物质中,Fe的还原性最强
B.上述反应涉及到的物质中,NaNO2的氧化性最强
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.![]() 的氧化性大于
的氧化性大于![]() 的氧化性
的氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
B.在200℃、101KPa时,H2与碘蒸气作用生成1 mol HI放出热量7.45kJ,其热化学方程式为I2(g)+H2(g)=2HI(g) ΔH=-14.9kJ/mol
C.已知在101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-242kJ/mol
O2(g)=H2O(g) ΔH=-242kJ/mol
D.25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,表示硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com