(2013?临沂三模)无水氯化铝是一种重要的化工原料,利用明矾石[K
2SO
4?Al
2(SO
4)
3?2Al
2O
3?6H
2O]制备无水氯化铝的流程如下:
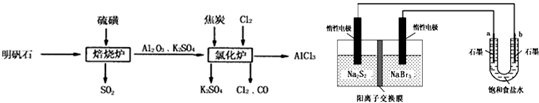
(1)焙烧炉中产生的SO
2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为
酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小
酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小
;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al
2O
3(s)+6Cl
2(g)?4AlCl
3(g)+3O
2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是
焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动
焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动
.
(3)生产氯化铝的过程中会产生SO
2、Cl
2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)
取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应
取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应
.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na
2S
2+NaBr
3Na
2S
4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为
.
②如图所示原电池放电时,电池中的Na
+向
右槽
右槽
(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为
2S22--2e-=S42-
2S22--2e-=S42-
.
③该原电池工作一段时间后,测得左槽中Na
+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为
11.2(a-b)
11.2(a-b)
L(不考虑气体的损失).

 (2013?临沂三模)[化学--物质结构与性质]
(2013?临沂三模)[化学--物质结构与性质]

 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.